
2.对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在溶液中是否存在的是( )
A.Br- B.SO42- C.H2SO3 D.NH4+
1.某白色固体可能由①氯化铵,②氯化铝,③氯化钠,④硝酸银,⑤氢氧化钾中的一种或几种组成,此固体投入水中得到澄清溶液,该溶液可使酚酞呈红色,若向溶液中加稀硝酸到过量,有白色沉淀生成。对原固体的判断不正确的是( )
A.肯定不存在② B.至少存在②和⑤
C.无法确定是否存在③ D.至少存在①、④、⑤
20.工业上用反应3NO2+H2O 2HNO3+NO生产硝酸,用NaOH溶液吸收硝酸厂排出的尾气中的NO和NO2气体。已知NO、NO2与NaOH溶液反应的化学方程式为:
2NaOH+NO+NO2 2NaNO2+H2O
2NaOH+2NO2 NaNO2+NaNO3+H2O
(1)在尾气中,NO占混合气体的体积分数为a%,NO2占混合气体的体积分数为b%。若尾气经过足量的NaOH溶液时,NO和NO2能被完全吸收,则a和b的关系是 。
(2)目前有一种治理NO污染的方法是在400℃左右,在催化剂存在的条件下,用氨还原NO,生成两种无害的物质,试写出反应的化学方程式 。
(3)用方法(2)同样可处理NO2气体,在同温同压下,每消耗1体积NH3可处理 体积NO2。
19.(1)实验室用二氧化锰跟浓硫酸共热反应,二氧化锰被还原成Mn2+并制取氯气的化学方程式是___________________________________。
(2)高锰酸钾是常用的氧化剂。在酸性条件下,MnO4-被还原成Mn2+。用高锰酸钾跟浓盐酸在室温下制氯气的反应的离子方程式是___________________________。
(3)历史上曾用“地康法”制氯气。该方法是用氯化铜作催化剂,在450℃利用空气中的氧气跟氯气反应制氯气,反应的化学方程式为________________________________。
(4)从氯元素化合价的变化看,以上三种方法的共同点是______________________。
(5)比较以上三个反应,可认为氧化剂的氧化能力从强到弱的顺序为________________。
18.请将下列高分子材料合成时所用的单体的结构简式填入下表:
|
编号 |
名称 |
结构简式 |
单体 |
|
例 |
涤纶 (的确凉) |
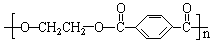 |
HOCH2CH2OH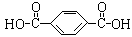 |
|
1 |
异戊橡胶 |
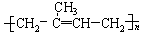 |
|
|
2 |
锦纶 (尼龙6) |
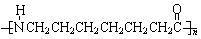 |
|
|
3 |
ABS树脂 |
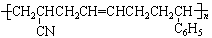 |
|
17.A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。
①元素Y在A、B、C、D、E中所呈现的化合价依次递增,其中只有B为单质;
②常温下将气体D通入水中发生反应,生成C和E;
③工业上以A、空气和水为原料,通过催化氧化法制取E。
请回答以下问题:
(1)B的电子式为:______,A的结构式为__________,A分子的空间构型是_______;
(2)写出②中涉及反应的化学方程式_______________。
(3)由B反应生成1 molA放出的热量为46.2kJ,写出该反应的热化学方程式,并注明反应条件________________________。
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应的化学方程式________________________。
16.(1)分别写出由氧在一定条件下生成下列物质的化学方程式(必须注明反应条件)
①O3:__________________________。②Na2O2_______________________________。
③Na2O_______________________。
(2)指出氧在下列各物质中的化合价:
O3___________;Na2O2___________;Na2O_________。
(3)KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应的化学方程式___________________。
(4)人体内O2-离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应的离子方程式:
( )O2-+( )H2O-( )H2O2+( )O2+( )
15.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg·L-1。现用氯氧化法处理。发生如下反应(其中N均为-3价):KCN+2KOH+Cl2→KOCN+2KCl+H2O
被氧化的元素是_______________________。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目:KOCN+KOH+Cl2-CO2+N2+KCl+H2O
(3)若处理上述废水20L,使KCN完全转化为无毒物质。至少需液氯____________g。
14.在过氧化物中加入乙醚后,再加入数滴K2Cr2O7的硫酸溶液,轻轻振荡后静置,乙醚层呈现蓝色,这是由于生成的过氧化铬(CrO5)溶于乙醚之故。CrO5的结构式如图所示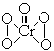 。
。
(1)在CrO5中氧元素的化合价为________。
(2)写出这一反应的离子方程式__________________________。
(3)这个反应______(填“是”或“不是”)氧化还原反应,其理由是________。
13.石榴石是石榴石族矿物的总称,颜色随成分的不同而变化,其组成可以表示为A3B2(SiO4)3,式中A、B均为金属元素,则A、B对应的化合价依次为( )
(A)+2,+3 (B)+3,+2 (C)+2,+2 (D)+3,+3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com