
1.某有机物结构简式为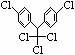 ,有关它的说法正确的是( )
,有关它的说法正确的是( )
A.它属于芳香烃 B.分子中最多可能有23个原子共面
C.分子式为C14H8Cl5 D.1mol该物质能与6 molH2加成
3.复习过程除了对球棍模型、比例模型的认识外,还要注意不同分子结构之间的联系之处。复习中要注意将有机物结构跟无机物结构联系起来,如高考中经常考到的水分子、水合氢离子、氨分子、铵离子、甲烷分子、白磷分子等之间都可找到联系。请看下图:
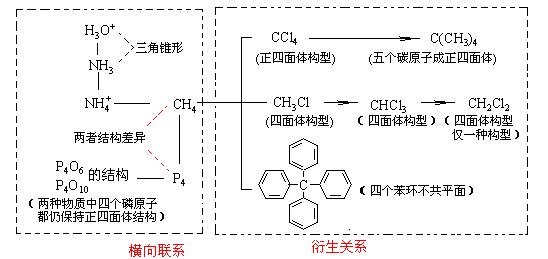
复习中不要孤立地去认识某种分子的结构,要注意寻找它们之间的联系,从整体上去把握。还要多观察课本中出现过的分子结构模型,认识各类模型的表现形式,从中理解分子结构。
[典型题析]
[例1] (2004年南通市高三测试题)下图是某有机物分子的比例模型,有关该物质的推断不正确的是( )
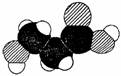
A.分子中可能含有羟基 B.分子中可能含有羧基
C.分子中可能含有氨基 D.该物质的分子式可能为C3H6O3
[解析]答案为C。中学化学课本中有许多分子结构的模型图,主要有球棍模型和比例模型两种。对分子结构模型的认识,既需要一定的空间想像能力,也需要有关分子结构的基础知识。这样命题可以测试考生对分子结构和空间思维能力。
先观察题给模型,可得该模型所表示的分子中有三种原子(黑球3个、斜线球3个、小白球6个),再根据有机化合物中原子形成共价键的规律来分析处理观察结果,黑球应该是C原子、斜线球是氧原子、小白球是氢原子。
[例2](2004年上海高考化学试题)某芳香族有机物的分子式为C8H6O2,它的分子(除苯环外不含其他环)中不可能有( )
A.两个羟基 B.一个醛基 C.两个醛基 D.一个羧基
[解析]答案选D。考查同分异构体的判断能力。同分异构体是一个重要概念,可以说同分异构体问题实际上是有机物结构问题,考查同分异构体的试题可触及到有机化学中的任何一块内容。以“根据分子式判断同分异构体”形式编制试题是考查同分异构体概念的常见题型。
根据题给分子可判断分子中只有一个苯环,由此入手可以写出如下所示的结构简式: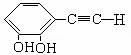 、C6H5COCHO、C6H4(CHO)2。
、C6H5COCHO、C6H4(CHO)2。
[例3]已知碳碳单键可以绕键轴自由旋转,结构简式为如下图所示的烃,下列说法中正确的是( )
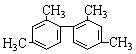 (A)分子中至少有9个碳原子处于同一平面上
(A)分子中至少有9个碳原子处于同一平面上
(B)分子中至少有10个碳原子处于同一平面上
(C)分子中至少有11个碳原子处于同一平面上
(D)该烃属于苯的同系物
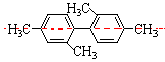 [解析]要判断A、B、C三个选项的正确与否,必须弄清题给分子的空间结构。题给分子看起来比较复杂,若能从苯的空间结构特征入手分析就容易理解其空间结构特征。分析这一分子的空间结构时易受题给结构简式的迷惑,若将题给分子表示为如图所示,就容易将“一个苯环必定有12个原子共平面”的特征推广到这题给分子中。以分子中的左边的苯环为中心分析,这个苯环上的6个碳原子、直接连在这个苯环上的2个甲基中的碳原子、另一个苯环中在虚线上的3个碳原子,共有11个碳原子必定在同一平面。所以答案为C。
[解析]要判断A、B、C三个选项的正确与否,必须弄清题给分子的空间结构。题给分子看起来比较复杂,若能从苯的空间结构特征入手分析就容易理解其空间结构特征。分析这一分子的空间结构时易受题给结构简式的迷惑,若将题给分子表示为如图所示,就容易将“一个苯环必定有12个原子共平面”的特征推广到这题给分子中。以分子中的左边的苯环为中心分析,这个苯环上的6个碳原子、直接连在这个苯环上的2个甲基中的碳原子、另一个苯环中在虚线上的3个碳原子,共有11个碳原子必定在同一平面。所以答案为C。
[例4]2002年诺贝尔化学奖的一半奖金授予了瑞士科学家库尔特维特里希,以表彰他“发明了利用核磁共振技术测定溶液中生物大分子三维结构的方法”。核磁共振技术是利用核磁共振谱来测定有机化合物结构,最有实用价值的就是氢谱,常用HNMR表示,如:乙醚分子中有两种氢原子,其HNMR谱中有两个共振峰,两个共振峰的面积比为3:2,而乙醇分子中有三种氢,HNMR谱中有三个峰,三个共振峰之间的面积比为3:2:1。
(1)请写出分子式C4H8在HNMR谱中两个峰面种为3:1的化合物的结构简式______。
(2)C4H10的HNMR谱有两种,其中作液体打火机燃料的C4H10的HNMR谱的两个峰的面积比为__________,结构简式__________;其同分异构体的两个峰的面种比为_________,结构简式为________________________。
[解析]题示信息“乙醚分子中有两种氢原子,其HNMR谱中有两个共振峰,两个共振峰的面积比为3:2,而乙醇分子中有三种氢,HNMR谱中有三个峰,三个共振峰之间的面积比为3:2:1”中可得出两个结论:一是有机分子中氢原子和种类数跟HNMR中共振峰个数相等;二是共振峰的面积比与有机分子中各类氢原子个数有关,如乙醚分子(CH3CH2OCH2CH3)中,两类氢原子的个数比为3:2,所以两个共振峰的面积之比为3:2。
所以答案为:
(1)分子式为C4H8的同分异构体有CH3CH2CH=CH2、CH3CH=CHCH3、CH2=C(CH3)2等,还有环丁烷、甲基环内烷等环烷烃。符合“两种氢原子(两个峰)”、“两类氢原子个数为3:1(共振峰面积之比为3:1)”这两项条件的只有CH3CH=CHCH3、CH2=C(CH3)2。
(2)作液体打火机燃料是正丁烷,正丁烷分子中有两类氢原子,个数比为3:2。所以答案为:3:2,CH3CH2CH2CH3;9:1,CH3CH(CH3)2。
[考题预测与专题训练]
2.总结归类有关有机物官能团、类别、常见同分异构体的类型等。
1.以同分异构为中心构建有机物结构方面的结构网络。
7.537℃、1.01×105Pa 时,往容积可变的密闭容器中充入2mol SO2、 1mol O2,此时容器的体积为200L。向容器中加入催化剂(固体)并保持恒温恒压,发生反应:
2SO2(气)+O2(气)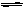 2SO3(气)
2SO3(气)
达到平衡时,平衡气体中SO3的体积分数为0.91。
试回答下列问题:
(1)工业上二氧化硫的催化氧化采用常压而不采用高压的原因是: _______。
(2)保持上述温度和压强不变,若向容器中只充入2mol SO3并加入固体催化剂。则平衡时,SO2的体积分数是 ,容器的体积为 L。
(3)温度仍保持537℃,容器体积保持200L不变(恒容)。充入a molSO2、b molO2,并加入固体催化剂,反应达平衡时,SO3的体积分数仍为0.91,体系压强为1.01×105Pa。若a:b=2:1,则a= 。
6.某化学反应2A 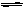 B+D在四种不同条件下进行,B、D起始浓度的起始浓度都为零,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度的起始浓度都为零,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
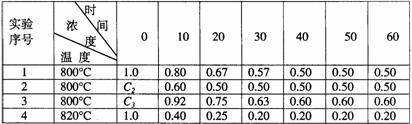
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol·L-1·min-1
(2)在实验2,A的初始浓度c2= mol·L-1,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<=),且c3 1.0 mol·L-1(填>、=、<=)。
(4)比较实验4和实验1,可推测该反应是__________反应(选填吸热、放热)。理由是________________。
5.在一条件下,可逆反应2A(气)+B(气)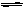 nC(固)+D(气)达平衡。若维持温度不变,增大强压,测得混合气体的平均相对分子质量不变,则下列判断正确的是( )
nC(固)+D(气)达平衡。若维持温度不变,增大强压,测得混合气体的平均相对分子质量不变,则下列判断正确的是( )
(A)其它条件不变,增大压强,平衡不发生移动
(B)其它条件不变,增大压强,混合气体的总质量不变
(C)该反应式中n值一定为2
(D)原混合气中A与B的物质的量之比为2:1,且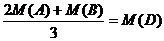 (其中M表示物质的摩尔质量)
(其中M表示物质的摩尔质量)
4.在一个密闭、恒容的容器中进行下列反应:4NH3(g)+5O2(g) 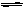 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
在一定的条件下达到平衡,现向反应容器中通入少量的氯化氢气体,产生的结果是( )
(A)容器内压强增大 (B)原平衡不受影响
(C)正反应速率增大 (D)NO浓度降低
3.一定条件下,在密闭容器里进行如下可逆反应:
S2Cl2(橙黄色液体)+Cl2(气) 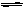 2SCl2(鲜红色液体)+61.16kJ。
2SCl2(鲜红色液体)+61.16kJ。
下列说法正确的是( )
(A)单位时间里生成n mol S2Cl2的同时也生成n molCl2
(B)达到平衡时,若升高温度,压强不变,反应混合溶液颜色变浅
(C)达到平衡时,单位时间里消耗 n mol S2Cl2的同时也生成n molCl2
(D)加入氯气,平衡向正反应方向移动,氯气的转化率一定升高
2.将8mol H2和2molN2充入2L密闭容器中,在一定条件下进行合成氨反应,4min后反应达到平衡,测得容器中还有5.6molH2。下列计算结果错误的是( )
(A)v(H2)=0.3 mol·L-1·min-1 (B)H2的转化率为25%
(C)NH3的物质的量浓度为0.8mol·L-1 (D)NH3的体积分数为19.05%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com