
16.由于金属锑的导电性介于导体与绝缘体之间以及它容易形成合金而具有很多重要用途。下列对锑元素(15Sb)的单质及其化合物的叙述不正确的是( )。
A.金属锑可用于制半导体材料
B.金属锑可用于制合金,以提高金属的硬度
C.金属锑及其化合物往往有毒,使用时要倍加小心
D.在火柴盒侧面涂有的三硫化二锑,用作氧化剂
15.石英玻璃是将纯石英在1600℃高温下熔化,冷却后形成的玻璃体。关于石英玻璃的结构和性质的叙述中正确的是( )
A.石英玻璃属于原子晶体
B.石英玻璃耐高温且能抵抗一切酸的腐蚀
C.石英玻璃的结构类似于液体
D.石英玻璃能经受高温剧变且能抗碱的腐蚀
14.A、B、C、D四种短周期元素,其离子A+、B2+、C-、D2-具有相同的电子层结构,下列判断正确的是( )
A.原子序数由大到小的顺序是:B>A>C>D
B.离子半径由大到小的顺序是:B2+>A+>C->D2-
C.A、B、C、D四种元素可能属于同一周期
D.A、B、C、D四种元素一定属于短周期元素
13.有M、R两种主族元素,已知M2-离子与R+离子核外电子数之和为20,则下列说法不正确的是( )
A.M与R的质子数之和一定等于19
B.M、R可能分别处于第二周期和第三周期
C.M、R可能分别处于第三周期和第二周期
D.M和R的质子数之差可能等于7
12.下列化学键中,都属于极性共价键的是( )
A.共价化合物中的化学键 B.离子化合物中的共价键
C.同种元素原子间的共价键 D.不同元素原子间的共价键
11.阴离子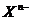 含中子N个,X的质量数为A,则a gX的氢化物中含质子的物质的量是( )
含中子N个,X的质量数为A,则a gX的氢化物中含质子的物质的量是( )
A.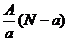 mol
B.
mol
B.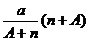 mol
mol
C.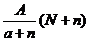 mol
D.
mol
D.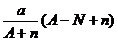 mol
mol
10.下列叙述正确的是( )
A.电子层数少的元素原子半径一定小于电子层数多的元素的原子半径
B.核外电子层结构相同的单核微粒半径相同
C.质子数相同的不同单核微粒,电子数越多,半径越大
D.原子序数越大,原子半径越大
9.下列比较关系中,正确的是( )
A.元素金属性Na>Mg>Al B.热稳定性H2S<H2Se<HCl
C.酸性H3PO3<H2SO4<HClO4 D.原子半径Mg>Na>H
8.下列对铯及其化合物的预测正确的是( )
A.铯的熔点很高 B.在自然界中,铯能以游离态存在
C.氯化铯易溶于水 D.铯只有一种氧化物Cs2O
7.下列说法正确的是( )
A.难失去电子的原子,易形成阴离子
B.单质分子中不存在化学键,化合物的分子才存在化学键
C.离子化合物中一定含有离子键
D.离子化合物中一定含金属键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com