
1、中和热
(1)概念:在101kPa时,1mol物质燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。燃烧热的单位一般用kJ/mol表示。
(2)注意:燃烧热是反应热的一种形式。使用燃烧热的概念时要理解下列要点。
① 规定是在101 kPa压强下测出热量。书中提供的燃烧热数据都是在101kPa下测定出来的。因为压强不同,反应热有所不同。
② 规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数。例如,C8H18的燃烧热为5518kJ/mol,用热化学方程式表示则为
C8H18(l)+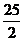 O2(g)= 8CO2(g)+9H2O(l);△H=-5518kJ/mol
O2(g)= 8CO2(g)+9H2O(l);△H=-5518kJ/mol
③ 规定生成物为稳定的氧化物.例如C→ CO2、H →H2O(l)、S →SO2等。
C(s)+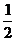 O2(g)=CO(g);△H=-110.5kJ/mol
O2(g)=CO(g);△H=-110.5kJ/mol
C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol
C的燃烧热为393.5kJ/mol而不是110.5kJ/mol。
④ 叙述燃烧热时,用正值,在热化学方程式中用△H表示时取负值。例如,CH4的燃烧热为890.3kJ/mol,而△H=-890.3kJ/mol。必须以1mol可燃物燃烧为标准。
5.无论热化学方程式中化学计量数为多少,△H的单位总是KJ·mol-1,但△H的数值与反应式中的系数有关。
10.将固体FeC2O4·2H2O放在一个可称量的容器中加热灼烧,固体质量随温度升高而变化,测得数据如下:
|
温度/℃ |
25 |
300 |
350 |
400 |
500 |
600 |
900 |
|
固体质量/g |
1.000 |
0.800 |
0.800 |
0.400 |
0.444 |
0.444 |
0.430 |
根据计算分析推理,完成下列填空:
(1)写出25-300℃时固体发生变化的反应方程式 判断的理由是 。
(2)350~400℃发生变化得到的产物是 ,物质的量之比为 。
(3)500℃时产物的含氧质量分数为 。
(4)写出600~900℃时发生变化的化学方程式 。
9.“铝和氯化铜溶液反应”实验中预料之外现象的研究
化学实验中预料之外的现象往往包含我们还没有认识的事物规律。下面是某同学进行“铝和氯化铜溶液反应”实验时观察到的预料之外的现象:
①铝丝表面附上的铜没有紧密吸附在铝丝的表面而是呈蓬松的海绵状;②反应一段时间后有大量气泡逸出,且在一段时间内气泡越来越快,经点燃能发出爆鸣声,证明是氢气。
“科学研究还离不开合理的猜想和假设。”该同学先从理论上猜想铝丝表面产生氢气的多种可能原因,再设计实验验证自己的猜想。
实验操作及现象记录:
取4根去油去锈的铝丝为A组直接和下列溶液反应,4根下半截缠上细铜丝的铝丝为B组和下列溶液反应,再取前面实验中得到的附有海绵状铜的4根铝丝洗净后作为C组和下列溶液反应作比较,实验现象记录如下:
|
|
热水 |
硫酸铜溶液(2.0mol/L) |
氯化铝热溶液(2.0mol/L) |
饱和氯化钠 热溶液 |
|
A |
只在开始时 有少量气泡 |
气泡较多,但比同浓度的氯化铜溶液少 |
有气泡, 比热水多 |
气泡比热水稍多,但比氯化铝溶液少 |
|
B |
气泡比相应A多 |
气泡比相应A多 |
气泡比相应A多 |
气泡比相应A多 |
|
C |
气泡比相应B多 |
气泡比相应B多 |
气泡比相应B多 |
气泡比相应B多 |
实验现象说明氢气的生成原因是多种因素作用的结果。试推测该同学原来的猜想有哪些(不一定填满,不够也可以自己添加):
(1)反应生成的铜和铝组成原电池促进铝和水反应;
(2) ▲ ;
(3) ▲ ;
(4) ▲ ;
(5) ▲ 。
8.铜与浓硝酸反应和铜与稀硝酸反应,产物不同,实验现象也不同。
(1)某课外活动小组为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置。请你根据他们的思路,选择下列药品,完成该实验,并叙述实验步骤。
药品:稀硝酸、稀盐酸、Zn粒、CaCO3固体。
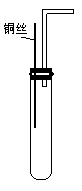 步骤:①检查装置的气密性;
步骤:①检查装置的气密性;
②向试管中加入一定量碳酸钙固体;
③
④
⑤将铜丝插入到溶液中;
⑥用注射器向广口瓶内推入氧气(或空气)。
(2)推入氧气或空气的目的是 。
(3)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差异的结果,你同意这种看法吗? (填“同意”或“不同意”),原因是 ;另一同学提出溶液呈“绿色”是Cu2+与NO2混合的结果,请你设计一个实验证明之(简述实验方案和实验现象) 。
7.完成下列反应的离子方程式:
(1)氢氧化铁溶于氢碘酸:
(2)苯酚钠溶液中通入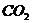 气体:
气体:
(3)氢氧化亚铁溶于稀 :
:
(4)已知H+比Ag+更易与NH3结合,要使[Ag(NH3)2]+转化为Ag+,应加入的有效试剂是 ,实现此反应的离子方程式为: 。
(5)① 在淀粉碘化钾溶液中,滴加少量的次氯酸钠溶液,立即会看到溶液变蓝色,这是因为: 。
② 在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠溶液,发现蓝色逐渐消失,这是因为: 。
③ 对比①和②所得的实验结果,将I2、ClO-、SO42-按氧化性强弱顺序排列为:
。
6.氯化铁是工业上常用的净水剂之一。
(1)请写出氯化铁净水的原理。
(2)为尽可能地降低净水生产费用,应该用廉价的原料来制备氯化铁,最好是三废的综合利用。请提出一些用廉价原料制取氯化铁的方法,写出有关的化学方程式,并对所提各种方法的优缺点加以评述。
5.将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如下:
 已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大。
已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大。
|
金属 |
电子流动方向 |
电压/V |
|
A |
A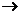 Cu Cu |
+0.78 |
|
B |
Cu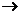 B B |
-0.15 |
|
C |
C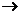 Cu Cu |
+1.35 |
|
D |
D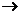 Cu Cu |
+0.30 |
请依据记录数据判断,下列有关说法正确的是( )
A.在四种金属中C的还原性最强
B.金属B能从硫酸铜溶液中置换出铜
C.A、D若形成原电池时,A为正极
D.A、B形成合金时,将该合金露置在空气中,A先被腐蚀
4.往100 mL FeCl3溶液中,通入0.672L标准状况下的硫化氢气体,设气体完全被吸收,再加入过量的铁粉,反应停止后,测得溶液中含有0.12mol金属阳离子,则原氯化铁溶液的物质的量浓度为( )
A. B.
B.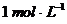 C.
C.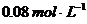 D.
D.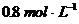
3.用足量的一氧化碳还原14.5g铁的氧化物的混合物。将生成的气体通入足量的澄清石灰水中,生成沉淀25g,则该混合物的组合不可能是( )
A.Fe2O3、Fe3O4、FeO B.FeO、Fe3O4 C.Fe3O4、Fe2O3 D.FeO、Fe2O3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com