
2.在某未知溶液中再溶入CH3COONa晶体,测得[Na+]与[CH3COO-]几乎相等,则原溶液可能是( )
A.HCl溶液 B.NaOH溶液 C.KCl溶液 D.KOH溶液
1.0.100 mol·L-1的Na2S的溶液中,下列关系不正确的是( )
A.c(H2S)+c(HS-)+c(S2-)=0.1 B.c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)
C.c(OH-)=c(H+)+ c(HS-)+2c(H2S) D.c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
4.电解原理及其应用
直流电通过电解质溶液时使阴阳两极发生氧化还原反应的过程。电解是一个电能转化为化学能的过程。
从参加反应的物质来分电解反应可分成五类:
(1)H2O型:实质是电解水。如电解硝酸钠、氢氧化钠、硫酸等溶液。
(2)溶质型:溶质所电离出来的离子发生氧化还原,如电解氯化铜、溴化氢等溶液。
(3)硫酸铜溶液型:电解产物是金属、氧气与酸。如电解硫酸铜溶液生成单质铜、氧气和硫酸,电解硝酸银溶液时生成单质银、氧气和硝酸。
(4)氯化钠溶液型:电解产物是非金属单质、氢气与碱。如电解氯化钠溶液时生成氯气、氢气和氢氧化钠,电解溴化钾溶液时生成溴单质、氢气和氢氧化钾。
(5)电镀型:镀层金属作阳极,阳极反应是:M- ne-=Mn+,镀件作阴极,阴极反应是:Mn++ne-=M。(电解精炼与电镀,实质上是相同的)
[典型题析]
[例1]熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混和物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,制得在650℃下工作的燃料电池。完成有关的电池反应式:
负极反应式:2CO+2CO32--4e-= 4CO2
正极反应式:
总电池反应式:
[解析]本题属于那种源于教材又高于教材的题型,从通常原电池的电解质溶液,一下过渡到熔融盐,不少人无法适应,当年高考失分也很严重。其实,我们只要从最基本的一点-燃料电池分析,其总电池反应式应为:2CO+O2=2CO2,然后逆向思考正极反应式-应为总反应式减去负极反应式,就可得出结果: O2+2CO2+4e-=2CO32-。
[例2]普通干电池中装有二氧化锰和其它物质,二氧化锰的作用是 ( )
A. 和正极作用把碳变成CO2
B. 把正极附近生成的H2氧化成水
C. 电池中发生化学反应的催化剂
D. 和负极作用,将锌变成锌离子Zn2+
[解析]锌锰干电池的负极材料是锌,故负极反应是Zn-2e-=Zn2+。正极导电材料是石墨棒。两极间为MnO2、NH4Cl、ZnCl2的糊状物。正极NH4+发生还原反应生成NH3和(H),继而被MnO2氧化为水,使碳极附近不致产生H2气泡而使电极极化,故MnO2也可称为正极的去极剂,使正极附近生成的H2氧化为水。正极反应:
2MnO2+2NH4++2e-==Mn2O3+2NH3+H2O
电池总反应为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O
本题答案为B。
[例3] (2004年湖北高考理综试题)将0.lmol·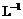 醋酸溶液加水稀释,下列说法正确的是( )
醋酸溶液加水稀释,下列说法正确的是( )
A.溶液中c(H+)和c(OH-)都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
[解析]答案为D。
主要考查电离平衡知识。弱酸的电离可联系到溶液的pH、物质的量浓度、水的电离平衡等基础知识,要用到化学平衡移动原理。要注意酸溶液稀释时,溶液的c(OH-)增大,同样碱溶液稀释时溶液中的c(H+)增大。
[例4](2004年北京高考理综试题)已知0.1mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)> c(OH-)
[解析]答案选C。
主要考查电离平衡、盐类水解等理论知识。弱电解质的电离平衡、盐类的水解平衡都会反映到溶液中各种离子浓度的关系之中,从分析离子关系角度考查电离平衡和盐类水解平衡理论知识,可以较好地区分学生对相关理论内容的理解水平。
根据题给条件可判断,H2A的第一级电离就较弱,属于弱酸。所以在Na2A、NaHA溶液中由于水解和电离,两溶液中所含离子种类数肯定相同。在Na2A溶液中,由于A2-水解,阴离子总数增加,在NaHA溶液中由于HA-水解阴离子总数要减小,所以两溶液中阴离子总数前者多。任何溶液中,阳离子所带正电荷总数跟阴离子所带负电荷总数必定相等。所以,在Na2A溶液中H+浓度小于OH-离子浓度。
[例5]剪长约6cm、宽2cm的铜片、铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2cm)。将铜片与铝片分别和电流表的“+”、“-”端相连接,电流表指针调到中间位置。取两个50mL的小烧杯,在一个烧杯中注入约40mL的浓硝酸,在另一只烧杯中注入40mL0.5mol/L的硫酸溶液。试回答下列问题:
(1)两电极同时插入稀硫酸中,电流表指针偏向 (填“铝”或“铜”)极,铝片上电极反应式为 ;
(2)两电极同时插入浓硝酸时,电流表指针偏向 (填“铝”或“铜”)极,此时铝是 (填“正”或“负”)极,铝片上电极反应式为 。
[解析]电极的确定依赖于具体的电极反应,在这个问题上,学生易受思维定势的影响,以为金属越活泼,便一定是负极,殊不知,在浓硝酸中,Al表面产生了钝化,发生反应的是Cu。因此,当Al、Cu同时插入稀硫酸时,电流表指针偏向Al。(电流方向从正极到负极)。电极反应式为:Al-3e-=Al3+。而当Al、Cu同时插入浓硝酸时,电流表指针偏向Cu,Al作正极,且电极反应式为:NO3-+4H++3e-=NO+2H2O。
[考题预测与专题训练]
3.原电池
(1)原电池的构成条件:这是一种把化学能转化为电能的装置.从理论上说,任何一个自发的氧化还原反应均可设计成原电池。
a. 负极与正极:作负极的一般是较活泼的金属材料,作正极的材料用一般导体即可
b. 电解质溶液:
c. 闭合回路
注意:通常两种不同金属在电解溶液中构成原电池时,较活泼的金属作负极,但也不是绝对的,严格地说,应以发生的电极反应来定.例如,Mg-Al合金放入稀盐酸中,Mg比Al易失去电子,Mg作负极;将Mg-Al合金放入烧碱溶液中,由于发生电极反应的是 Al,故Al作负极。
(2)原电池的工作原理:
(1)电极反应(以铜锌原电池为例):负极:Zn-2e-=Zn2+ (氧化反应)
正极:2H++2e-=H2↑(还原反应)
(2)电子流向:从负极(Zn)流向正极(Cu)
(3)电流方向:从正极(Cu)流向负极(Zn)
(4)能量转变:将化学能转变成电能
(3)电极反应:
在正、负极上发生电极反应不是孤立的,它往往与电解质溶液紧密联系。如氢-氧燃料电池,它的负极是多孔的镍电极,正极为覆盖氧化镍的镍电极,电解质溶液是KOH溶液,在负极通入H2,正极通入O2,电极反应:
负极:2H2+4OH--4e-=4H2O
正极:O2+2H2O+4e-=4OH-
负极的反应我们不能写成:2H2-4e-=4H+。因生成的H+会迅速与OH-生成H2O。
(4)金属的腐蚀:
金属的腐蚀分为两类:
(1) 化学腐蚀:金属或合金直接与周围介质发生反应而产生的腐蚀。
(2) 电化腐蚀:不纯的金属或合金因发生原电池反应而造成的腐蚀。
最普遍的钢铁腐蚀是:负极:2Fe-4e-=2Fe2+
正极:O2+2H2O+4e-=4OH-
(注:在少数情况下,若周围介质的酸性较强,正极的反应是:2H++2e-=H2↑)
|
|

 2Fe-4e-=2Fe2+
2Fe-4e-=2Fe2+
O2+2H2O+4e-=4OH-
 2Fe(OH)3=Fe2O3·nH2O+(3-n)H2O
2Fe(OH)3=Fe2O3·nH2O+(3-n)H2O
(5)金属的防护
一般有三条途径:其一是改变金属内部结构,如制成合金,其二是涂保护层,其三是电化学保护法。例如在铁表面镀上锌或锡,即成白铁与马口铁,但一旦破损,因原电池反应,白铁外面的锌可进一步起保护作用,而马口铁外面的锡反而会加速腐蚀(铁作负极被溶解)。
2.本部分内容的知识体系
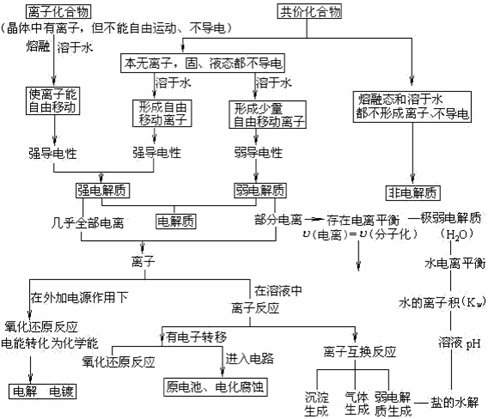
1.本章内容的核心是实质是化学平衡移动原理的具体应用,电离平衡、水解平衡、原电池反应、电解反应中都涉及到化学平衡移动原理。下表列举了这部分内容中的跟平衡移动有关的一些实例:
表:化学平衡与其它各类平衡的关系
|
知识内容 |
与化学平衡之间的联系 |
|
弱电解质的电离 |
电离平衡实质上就是一种化学平衡,可以用化学平衡移动原理对弱电解质的电离平衡作定性的、或定量的分析。根据电离度大小可比较弱电解质相对强弱,根据相应盐的水解程度也可比较弱电解质的相对强弱。 |
|
水的电离 |
水是一种很弱的电解质,加酸、加碱会抑制水的电离,升高温度会促进水的电离。Kw=[OH-][H+]是水的电离平衡的定量表现,H+、OH-浓度可以用这个关系进行换算。 |
|
盐类水解 |
盐类水解(如F-
+ H2O 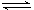 HF + OH-)实质上可看成是两个电离平衡移动的综合结果:①水的电离平衡向正方向移动(H2O HF + OH-)实质上可看成是两个电离平衡移动的综合结果:①水的电离平衡向正方向移动(H2O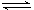 H++OH-),②另一种弱电解质的电离平衡向逆方向移动(HF H++OH-),②另一种弱电解质的电离平衡向逆方向移动(HF  F-+H+)。也可以看成是中和反应的逆反应,升高温度会促进水解。 F-+H+)。也可以看成是中和反应的逆反应,升高温度会促进水解。 |
|
中和滴定 |
水的电离程度很小, H++OH-=H2O的反应程度很大,所以可以利用这个反应进行中和滴定实验,测定酸或碱溶液的浓度。 |
|
原电池反应和电解反应 |
原电池反应和电解反应实质是氧化还原反应,其特点是一个氧化还原反应分成了两个电极反应(却氧化反应、还原反应分别在不同的电极上发生反应)。一些原电池的电极反应(如钢铁的吸氧腐蚀正极的电极反应O2+2H2O+4e = 4OH-)涉及到水的电离平衡移动造成pH变化。电解硫酸、氢氧化钠、氯化钠等溶液过程中,在阴极或阳极附近由于电极反应而使水的电离平衡发生移动造成pH变化。 |
2、有关反应热的计算
(1)盖斯定律及其应用
化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关,如果一个反应可以分几步进行,则各分步及反应的反应热之和与该反应一步完成的反应热是相同的,这就是盖斯定律。
例如:
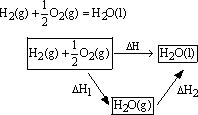
可以通过两种途径来完成。如上图表:已知:
H2(g)+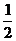 O2(g)= H2O(g);△H1=-241.8kJ/mol
O2(g)= H2O(g);△H1=-241.8kJ/mol
H2O(g)=H2O(l);△H2=-44.0kJ/mol
根据盖斯定律,则
△H=△H1+△H2=-241.8kJ/mol+(-44.0kJ/mol)=-285.8kJ/mol
其数值与用量热计测得的数据相同。
例2、科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。
(1)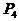 (s,白磷)+
(s,白磷)+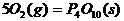
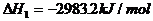
(2)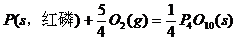
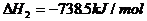
则白磷转化为红磷的热化学方程式_____________。相同的状况下,能量较低的是_________;白磷的稳定性比红磷___________(填“高”或“低”)。
解析:依题意求: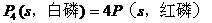 ;
; 可设计如下反应过程:
可设计如下反应过程: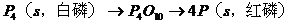 ;据盖斯定律有
;据盖斯定律有 =(-2983.2+4×738.5)kJ/mol=-29.2kJ/mol,即
=(-2983.2+4×738.5)kJ/mol=-29.2kJ/mol,即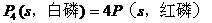 ;
;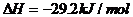 。白磷转化为红磷是放热反应,稳定性比红磷低(能量越低越稳定)。
。白磷转化为红磷是放热反应,稳定性比红磷低(能量越低越稳定)。
变式练习2、(2005广东22·4) 由金红石(TiO2)制取单质Ti,涉及到的步骤为::
TiO2 TiCl4
TiCl4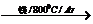 Ti
Ti
已知:① C(s)+O2(g)=CO2(g); DH=-393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
答案:-80 kJ·mol-1
(2) 根据一定量的物质参加反应放出的热量(或根据已知的热化学方程式),进行有关反应热的计算或比较大小。
例3、已知: ;
;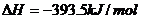
 ;
;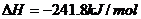
欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为
A. 2:3.25 B. 12:3.25 C. 1:1 D. 393.5:241.8
解析:由题意可列得方程
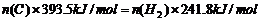

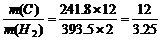 答案: B
答案: B
例4、在同温同压下,下列各组热化学方程式中,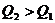 的是
的是
A. 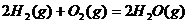
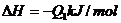
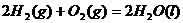
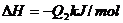
B. 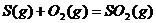
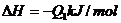
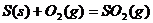
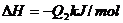
C.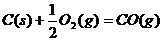
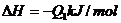

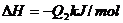
D.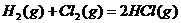
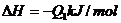
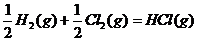
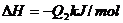
解析:反应热数值的大小与反应物、生成物的种类有关,与反应物物质的量的多少有关,与反应物和生成物的聚集状态有关,还与反应时的外界条件有关。A选项:生成物的状态不同,由于从气态水到液态水会放热,所以生成液态水比生成气态水放出的热多即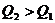 ;B选项:反应物的状态不同,由于从固态硫到气态硫要吸热,所以气态硫燃烧放出的热量比固态硫燃烧放出的热量多,即
;B选项:反应物的状态不同,由于从固态硫到气态硫要吸热,所以气态硫燃烧放出的热量比固态硫燃烧放出的热量多,即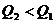 ;C选项:生成物的种类不同,由于CO与O2反应生成CO2要放出热量,故
;C选项:生成物的种类不同,由于CO与O2反应生成CO2要放出热量,故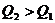 ;D选项:反应物的物质的量不同,前一反应的物质的量是后一反应的物质的量的2倍,故
;D选项:反应物的物质的量不同,前一反应的物质的量是后一反应的物质的量的2倍,故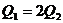 ,即
,即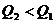 。答案选A、C。
。答案选A、C。
变式练习3、(2005江苏4)氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l); △H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g); △H=-283.0kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);△H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l); △H=-89.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是
A H2(g) B CO(g) C C8H18(l) D CH4(g)
(3)利用键能计算反应热 方法:ΔH=∑E(反应物)-∑E(生成物),即反应热等于反应物的键能总和跟生成物的键能总和之差。 通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能常用E表示,单位是kJ/mol。 例题5.CH3-CH3→CH2=CH2+H2;有关化学键的键能如下。 化学键 C-H C=C C-C H-H 键能(kJ/mol) 414.4 615.3 347.4 435.3
试计算该反应的反应热 解析:ΔH =[6E(C-H)+E(C-C)]-[E(C=C)+4E(C-H)+E(H-H)]=(6×414.4+347.4)kJ/mol-(615.3+4×414.4+435.3)kJ/mol=+125.6 kJ/mol 这表明,上述反应是吸热的,吸收的热量为125.6 kJ/mol。 题型三:燃烧热、中和热的判断、求算及测量
例6、下列说法正确的是
A. 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热
B. 酸和碱发生中和反应生成1mol水,这时的反应热叫中和热
C. 燃烧热或中和热是反应热的种类之一
D. 在稀溶液中,1molCH3COOH和1mol NaOH完全中和时放出的热量为57.3kJ
解析:本题旨在考查对燃烧热、中和热的定义的理解,特别是两概念中应注意的问题,故不难确定答案为C。
例7、在101kPa时,H2与1.00mol O2完全燃烧,生成2.00mol液态水,放出571.6kJ的热量,表示氢气燃烧热的热化学反应方程式为____________。
解析:燃烧热是指1mol可燃物完全燃烧时放出的热量。据2H2(g)+O2(g)= 2H2O(1)知燃烧1molH2应放出285.8kJ热量,即燃烧的热方程式为:
H2(g)+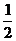 O2(g)= H2O(l);△H=-285.8kJ/mol
O2(g)= H2O(l);△H=-285.8kJ/mol
1. 已知一定量的物质参加反应放出的热量,写出其热化学反应方程式。
例1、将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_____________。又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
解析:0.3mol乙硼烷完全燃烧生成液态水放出649.5kJ热量,则1mol乙硼烷完全燃烧放出的热量为: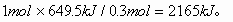 因此乙硼烷燃烧的热化学反应方程式为:
因此乙硼烷燃烧的热化学反应方程式为: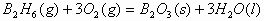
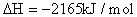 。由于1mol水汽化需吸热44kJ,则3mol液态水全部汽化应吸热:
。由于1mol水汽化需吸热44kJ,则3mol液态水全部汽化应吸热: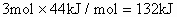 ,所以1mol乙硼烷完全燃烧产生气态水时放热:
,所以1mol乙硼烷完全燃烧产生气态水时放热: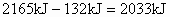 ,则11.2L(标准状况)乙硼烷完全燃烧产生气态水放出热量是:
,则11.2L(标准状况)乙硼烷完全燃烧产生气态水放出热量是: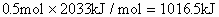 。
。
变式练习1、(2005全国理综Ⅰ·13).已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=-2b kJ / mol
B. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l); ΔH=2b kJ / mol
C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=-4b kJ / mol
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=b kJ / mol
解析:以上各式中化学计量数及物质状态标注都正确;该反应放热,△H应为负值;生成1mol二氧化碳气体,放出热量 bkJ,则又生成4mol二氧化碳气体,放出热量4bkJ 。 答案:A。
2、中和热
(1)概念:在稀溶液中,酸跟碱发生中和反应而生成1mol H2O,这时的反应热叫中和热。
(2)中和热的表示:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol。
(3)注意:
① 这里的稀溶液一般要求酸溶液中的c(H+)≤1mol/L,碱溶液中的c(OH-)≤1mol/L。这是因浓酸溶液和浓碱溶液相互稀释时会放出热量。
②强酸与强碱的中和反应其实质是H+和OH-反应(即与酸、碱的种类无关),通过许多次实验测定,1molH+和1molOH-反应生成1molH2O时,放出热量57.3kJ。其热化学方程式为
H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol
因此,下列中和反应的△H相同,都为-57.3kJ/mol。
③ 中和热是以生成1molH2O为基准,因为表示中和热的热化学方程式中,水的化学计量数为1,其酸、碱或盐的化学计量数可以为分数.必须以生成1mol水为标准;中和反应对象为稀溶液;强酸与强碱中和时生成1mol H2O均放热57.3kJ,弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于57.3kJ/mol。
典型例题剖析:
题型一:有关热化学反应方程式的的含义及书写
3. 表示的意义:例如C的燃烧热为393.5kJ/mol,表示在101kPa时,1molC完全燃烧放出393.5kJ的热量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com