
4.下列计时数据,指时刻的是 ( )
A.高考数学考试的时间是2 h
B.四川省汶川县发生8.0级强烈地震是在2008年5月12日14时28分
C.人造卫星绕地球一圈的时间为1.4 h
D.由青岛开往通化的1406次列车在德州站停车3 min
3.以下的计时数据中指时间间隔的是
A.“嫦娥一号”卫星于2007年10月24日18时5分点火发射
B.第29届奥运会于2008年8月8日20时8分在北京开幕
C.刘翔创造了12.88秒的110米栏最好成绩
D.在一场NBA篮球赛开赛8分钟时,姚明投中第三个球
2.下列说法中,与人们的日常习惯相吻合的是 ( )
A.测量三楼内日光灯的高度,选择地面为参考系
B.测量井的深度,以井底为参考系,井深为0
C.以卡车司机为参考系,判断卡车是否运动
D.以路边的房屋为参考系判断自己是否运动
1.在下列情形中,可以将研究对象看做质点的是
A.地面上放一只木箱,在上面的箱角处用水平力推它,在研究它是先滑动还是先翻转时
B.在08年北京奥运会上研究菲尔普斯在游泳比赛中的手脚动作时
C.研究“嫦娥一号”卫星在绕地球飞行及绕月球飞行的轨迹时
D.研究“嫦娥一号”在轨道上飞行的姿态时
3.在101325 Pa、120℃时,某气态烃和过量O2在一密闭容器内完全燃烧,在相同条件下反应前后容器内的压强相等。求该烃可能的分子式。
解析:本题可采用规律法求解。因分子中氢原子数为4的烃,在相同条件下燃烧前后(水为气态)气体物质的量不变,压强相等。应用这一规律可得该烃的分子式可能为CH4、C2H4或C3H4。
答案:该烃的分子式可能为CH4、C2H4或C3H4。
2.取3.40 g只含羟基,不含其他官能团的液体饱和多元醇,置于5.00 L氧气中。经点燃醇完全燃烧。反应后气体体积减少0.56 L,将气体通过CaO进行吸收,体积又减少2.80 L(所有体积均已换算成标准状况下的体积)。
(1)3.4 g醇中C、H、O的物质的量分别为:
n(C)=______ mol,n(H)=______ mol,n(O)=______ mol;该醇中C、H、O原子数之比为: 。
(2)从以上比值能否确定该醇的分子式?其原因是 。
答案:(1)n(C)=0.125 mol n(H)=0.300 mol
n(O)=0.100 mol C、H、O原子个数比为5∶12∶4
(3)从以上比值能确定该醇的分子式。其原因是该最简式中H原子数已饱和,所以最简式即分子式C5H12O4。
0.02 x×44+0.01y×18=3.72
解得:x=3 y=6
3×12+6+16z=58 z=1
∴分子式为C3H6O
0.02 mol 0.02 mol 0.01 mol
依题意:0.02 x=0.01 y 2x=y
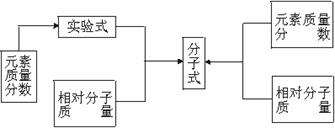
(1)根据相对分子质量和元素质量分数求分子式。
(2)根据气态有机物密度或相对密度求分子式。
(3)根据有机物在化学反应中量的关系求分子式。
●教学说明
有机物分子式的确定是初中阶段有关化学式计算的延伸。本节课的学习对于学生认识未知世界,探索形形色色的物质世界,推断物质的元素组成,确定其分子式,提供了一定的知识基础。因此在教学过程中应重视培养学生严肃认真的科学态度、严密的科学思维方法以及良好的学习习惯。注意把前后知识有机地结合起来,进一步达到新旧知识的融会贯通。在以后的授课中,还要注意对此部分内容进行不断的巩固和练习。
●参考练习
1.某有机物的蒸气密度是相同状况下甲烷密度的3.625倍。把1.1 g该有机物在氧气中充分燃烧,将生成的气体混合物通过足量碱石灰,碱石灰增重3.72 g,又知生成H2O和CO2物质的量之比为1∶1。求此有机物的分子式。
解:Mr=16×3.625=58
∴n=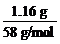 =0.02 mol
=0.02 mol
CxHyOz+(x+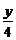 -
-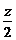 )O2
)O2 xCO2 +
xCO2 +
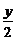 H2O
H2O
1 mol
x mol 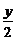 mol
mol
[师]确定物质的分子式,即确定物质分子里所含元素的种类和原子的数目。元素的种类,有些是由实验直接测出的,有些则还需对实验现象和结果作必要的分析和计算才能得出。各元素原子的数目,通常是根据测得的相对分子质量及各元素的质量百分含量来求得。具体如何求解,下面我们通过例题共同讨论得出。
[板书](1)根据相对分子质量和元素质量分数求分子式
[投影]例1:实验测得某碳氢化合物A中,含碳80%、含氢20%,求该化合物的实验式。又测得该化合物的相对分子质量是30,求该化合物的分子式。
[师]只根据C、H两元素的质量分数能否求得该烃的分子式?
[生]不能。因为根据各元素的质量分数只能求得该物质的分子中各元素原子数目的最简整数比,而无法确定该物质分子中各元素原子的具体数目。
[师]很正确。表示化合物分子中所含各元素原子数目最简整数比的式子,叫最简式或实验式。与分子式不同,分子式是表示化合物所含元素的原子种类及数目的式子。实验式不能表示分子的真实组成而分子式可以。
[问]已知最简式,还需知道什么条件就可求得分子式?
[生]相对分子质量。
[师]对,下面我们共同求解例1。
[板书]例1:解:(1)求化合物的实验式即是求该化合物分子中各元素原子的数目(N)之比。
|
|
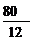 ∶
∶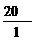 =1∶3
=1∶3
该化合物的实验式是CH3。
(2)设该化合物分子式为(CH3)n,则:
n=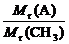 =
=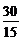 =2
=2
该化合物的分子式是C2H6。
答:该碳氢化合物的实验式是CH3,分子式是C2H6。
[师]例1中的A的分子式还可以采用什么方法求解?
[生]根据分子式所表示的意义,只要我们确定1 mol A分子中所含各元素原子的物质的量,即确定了A分子式中各元素原子的数目。
[师]回答得很好,下面我们再用这种方法来求出A的分子式。
[板书]或:解:1 mol A分子中所含各元素原子的物质的量为:
n(C)=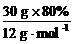 =2 mol
=2 mol
n(H)=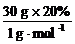 =6 mol
=6 mol
因此,该化合物的分子式为C2H6。
[师]除了以上两种方法以外,哪位同学还有不同的方法?
[生]直接用相对分子质量除以12来求。
[师]很好。这也是求化学式的一种方法即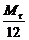 =n…m则化学式为CnHm。这种方法在解选择题或填空题时使用,可以节省时间。但作为计算题,尤其是已知元素质量分数时,一般不用。
=n…m则化学式为CnHm。这种方法在解选择题或填空题时使用,可以节省时间。但作为计算题,尤其是已知元素质量分数时,一般不用。
请大家根据以上解题方法做下面练习。
[投影练习]某有机化合物由三种元素组成,其中碳、氢质量分数分别为22.0%和4.59%。将该化合物在强碱水溶液中水解后先用HNO3酸化,再用AgNO3溶液试验,结果生成淡黄色沉淀。又测得该化合物的相对分子质量为109,求该有机化合物的分子式。
[学生活动,教师巡视]
[投影]解法1:该有机化合物为溴代烷,其中溴元素的质量分数为:100%-22.0%-4.59%=73.41%
1 mol该有机化合物中所含各元素原子的物质的量分别为:
n(C)=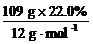 =2 mol
=2 mol
n(H)=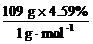 =5 mol
=5 mol
n(Br)=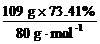 =1 mol
=1 mol
所以,该有机化合物的分子式为C2H5Br。
解法2:据题意,该有机化合物中还含有溴元素,其质量分数为:100%-22.0%-4.59%=73.41%
该有机化合物各元素原子个数之比
N(C)∶N(H)∶N(Br)=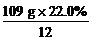 ∶
∶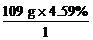 ∶
∶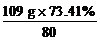 =2∶5∶1
=2∶5∶1
设该化合物的分子式为(C2H5Br)n
n=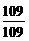 =1
=1
该化合物分子式为C2H5Br。
答:该有机化合物的分子式为C2H5Br。
[投影小结]已知物质中各元素的质量分数和物质的相对分子质量,求物质分子式的方法是:
[过渡]对于气态的有机物有时告知其分子的相对分子质量或相对密度,此时如何求分子式呢?下面我们看例题:
[板书](2)根据气态有机物密度或相对密度求分子式
[投影]例2: 2.3 g某有机物A完全燃烧后,生成0.1 mol CO2和2.7 g H2O,测得该化合物的蒸气与空气的相对密度是1.6,求该化合物的分子式。
[师]根据题意,该有机物燃烧的产物只有CO2和H2O,因此该有机物中一定含有C和H两种元素,是否含O元素,我们该如何确定呢?
[生]根据燃烧前后C、H质量守恒,可由产物CO2和H2O中含C、H的质量计算出有机物中C、H的总质量。若m(有机物)=m(C)+m(H)则有机物中只含C、H两种元素;若m(有机物)>m(C)+m(H),则有机物中含C、H、O三种元素,m(O)=m(有机物)-m(C)-m(H)。
[师]这位同学分析得很全面。下面请同学们按照该思路来求解例2。
[请一位同学到黑板上计算]
[学生板演]解:(1)求2.3 g该有机物中组成元素的质量
根据C、H守恒可求得
m(C)=0.1 mol×12 g·mol-1=1.2 g
m(H)=2.7 g×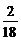 =0.3 g
=0.3 g
m(C)+m(H)=1.5 g<2.3 g
因此A中还含有O,其质量为
m(O)=m(A)-m(C)-m(H)=2.3 g-1.5 g=0.8 g
(2)求该有机物的相对分子质量
Mr(A)=dMr(空气)=1.6×29=46
(3)确定该有机物的分子式
由于N(C)∶N(H)∶N(O)=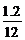 ∶
∶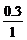 ∶
∶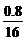 =2∶6∶1
=2∶6∶1
所以该有机物的实验式为C2H6O
设有机物A的分子式为(C2H6O)n
n=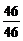 =1
=1
故该有机物A的分子式为C2H6O。
答:该有机物的分子式为C2H6O。
[师]据例1,这位同学的第三步还可以采用什么方法确定有机物的分子式?
[生]利用1 mol分子中所含各元素原子的物质的量求解。
[师]再请一位同学到黑板上求解。
[学生板演]1 mol A分子中含各元素原子的物质的量为
n(C)=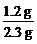 ×46 g÷12 g·mol-1=2 mol
×46 g÷12 g·mol-1=2 mol
n(H)=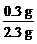 ×46 g÷1 g·mol-1=6 mol
×46 g÷1 g·mol-1=6 mol
n(O)=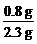 ×46 g÷16 g·mol-1=1 mol
×46 g÷16 g·mol-1=1 mol
因此A的分子式为C2H6O。
[过渡]如果已知某气态化合物的密度,能否求出其分子量,再求其分子式呢?下面我们再做一道题。
[投影显示]
例3:某气态烃在标准状况下150 mL的质量是0.5223 g,经测定,该烃含碳92.3%,含氢7.7%,试求它的分子式。
[师]本题是根据气体密度和元素含量计算有机物分子式的常见题型。若能根据标况下的体积和质量求出它的相对分子质量,那么就可以利用例1或例2的解题方法来计算了。下面请同学们自己思考本题应如何做。
[学生思考后写出各自的解法,教师总结并板书]
解法(1):求相对分子质量M=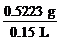 ×22.4
L/mol=78 g/mol
×22.4
L/mol=78 g/mol
∴该烃的相对分子质量为78。
求C、H原子个数比,得出实验式:
N(C)∶N(H)=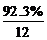 ∶
∶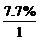 =1∶1。
=1∶1。
实验式为CH,则分子组成为(CH)n。
∴13n=78 n=6
∴分子式为C6H6
解法(2):
相对分子质量计算方法同上。
N(C)=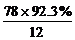 =6 N(H)=
=6 N(H)=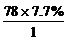 =6
=6
∴分子式为C6H6。
[过渡]我们知道烃的组成可表示为CxHy,烃的含氧衍生物的组成可表示为CxHyO,若为饱和一元醇则可用CnH2n+1OH表示,据此,还可以写出以通式表示的有机反应的化学方程式。若已知这些有机化学反应中各物质间量的关系,就可以求算有机物的分子式。通常计算有两种方法:一是根据有关生成物的量,求出有机物中元素的含量,再结合相对分子质量的计算,将此类问题用前面几道例题的方法解答;二是写出用有机物通式表示的化学方程式,利用方程式求出有机物的相对分子质量,或直接利用反应通式确定分子式。下面我们来看一道例题。
[板书](3)根据有机物在化学反应中量的关系求分子式
[投影]例4: 0.60 g某饱和一元醇A,与足量的金属钠反应,生成氢气112 mL(标准状况)。求该一元醇的分子式。
[学生计算,教师巡视]
[投影]求解上题的规范步骤:
解:饱和一元醇的通式为CnH2n+1OH,该一元醇的摩尔质量为M(A)
2CnH2n+1OH+2Na 2CnH2n+1ONa+H2↑
2CnH2n+1ONa+H2↑
2 mol×M(A) 22.4 L
0.60 g 0.112 L
M(A)=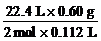 =60 g·mol-1
=60 g·mol-1
该一元醇的相对分子质量为60
根据该一元醇的通式,有下列等式:
12n+2n+1+16+1=60
n=3
答:该一元醇的分子式是C3H8O。
[投影练习]
某有机物4.5 g,完全燃烧后生成2.7 g H2O和3.36 L CO2(标况),该有机物的蒸气对H2相对密度为30,求该有机物的分子式。
解:该有机物中各元素的质量为:
C: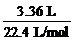 ×12 g/mol=1.8 g
×12 g/mol=1.8 g
H:2.7 g×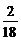 =0.3 g
=0.3 g
O:4.5 g-1.8 g-0.3 g=2.4 g
则N(C)∶N(H)∶N(O)=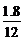 ∶
∶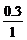 ∶
∶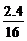 =1∶2∶1
=1∶2∶1
∴最简式为CH2O 设化学式为(CH2O)n
则30n=60 n=2即有机物分子式为C2H4O2
[师]请同学们根据以上例题和练习,讨论求有机物的分子式需要知道哪些数据?
[学生讨论后小结]
①相对分子质量及元素质量分数。
②有机物在反应中各反应物及生成物的量的关系。
[师]通过计算确定分子式之后,还需根据其特殊性质或实验确定结构式。具体方法我们下节课再学习。
[布置作业]P159一、二、四、1.2.
●板书设计
第三节 有机物分子式和结构式的确定(一)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com