



 对有机物性质的考查以化学性质为主,有时也涉及物理性质。分析有机物的性质时主要考虑官能团的性质,有时也要注意碳链对官能团性质的影响,如醇和酚中都有-OH和烃基,但是二者-OH所表现出的性质并不相同。此外,同类有机物物理性质的递变主要决定于烃基的不同
对有机物性质的考查以化学性质为主,有时也涉及物理性质。分析有机物的性质时主要考虑官能团的性质,有时也要注意碳链对官能团性质的影响,如醇和酚中都有-OH和烃基,但是二者-OH所表现出的性质并不相同。此外,同类有机物物理性质的递变主要决定于烃基的不同
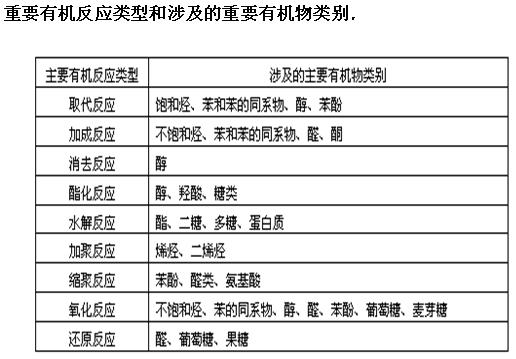
有机反应基本类型
(1)有机反应基本类型
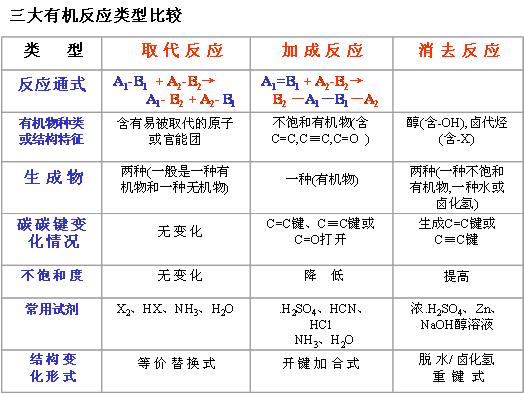
1、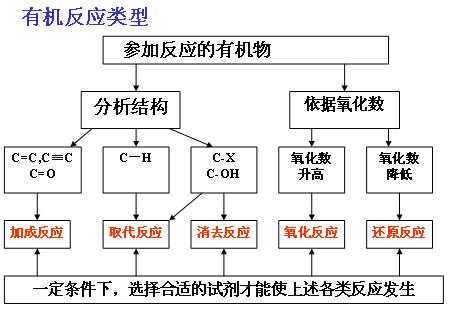 取代:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应;2、加成:有机物分子中双键三键两端的碳原子与其它原子或原子团直接结合生成新的化合物的反应;3、消去:有机化合物在适当的条件下,从一个分子脱去一个小分子(如水、卤化氢等分子),而生成不饱和(双键或三键)化合物的反应;4、氧化:有机物分子中加入氧原子或失去氢原子的反应;5、还原:有机物分子中加入氢原子或失去氧原子的反应;6.加聚:分子量小的化合物(单体)分子相互结合成为分子量很大的化合(高分子化合物)的分子:
取代:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应;2、加成:有机物分子中双键三键两端的碳原子与其它原子或原子团直接结合生成新的化合物的反应;3、消去:有机化合物在适当的条件下,从一个分子脱去一个小分子(如水、卤化氢等分子),而生成不饱和(双键或三键)化合物的反应;4、氧化:有机物分子中加入氧原子或失去氢原子的反应;5、还原:有机物分子中加入氢原子或失去氧原子的反应;6.加聚:分子量小的化合物(单体)分子相互结合成为分子量很大的化合(高分子化合物)的分子:
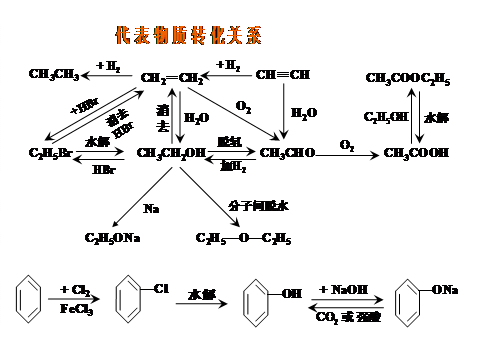
 (2)重要物质的转化关系
(2)重要物质的转化关系
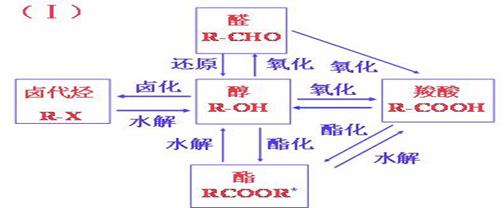
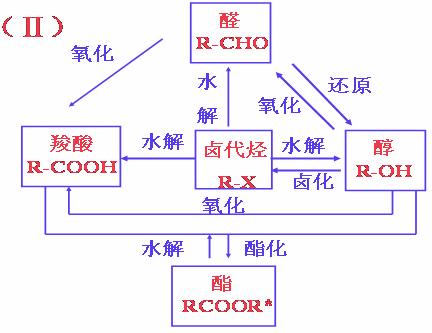
常见的实验现象与相应的结构:
(1)遇溴水或溴的CCl4溶液褪色: 或C≡C;遇FeCl3溶液显紫色:酚;
或C≡C;遇FeCl3溶液显紫色:酚;
(2)遇石蕊试液显红色:羧酸;与Na反应产生H2:含羟基化合物(醇、酚或羧酸)
(3)与Na2CO3或NaHCO3溶液反应产生CO2:羧酸;
(4)与Na2CO3溶液反应但无CO2气体放出:酚;
(5)与NaOH溶液反应:酚、羧酸、酯或卤代烃;
(6)发生银镜反应或与新制的Cu(OH)2悬浊液共热产生红色沉淀:醛;
(7)常温下能溶解Cu(OH)2:羧酸;
(8)能氧化成羧酸的醇:含“─CH2OH”的结构(能氧化的醇,羟基相“连”的碳原子上含有氢原子;能发生消去反应的醇,羟基相“邻”的碳原子上含有氢原子);
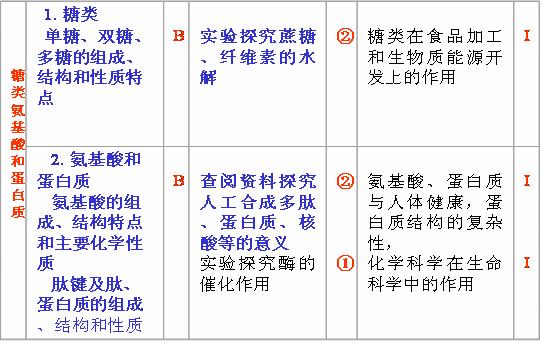
(9)能水解:酯、卤代烃、二糖和多糖、酰胺和蛋白质;
(10)既能氧化成羧酸又能还原成醇:醛;
②定量分析:由反应中量的关系确定官能团的个数;
常见反应的定量关系:
(1)与X2、HX、H2的反应:取代(-H-X2);加成( -X2或HX或H2;
-X2或HX或H2;
 -C≡C--2
-C≡C--2
X2或2HX或2H2; - 3H2)
(2)银镜反应:─CHO-2Ag;(注意:HCHO-4Ag)
(3)与新制的Cu(OH)2反应:─CHO-2Cu(OH)2;2─COOH- Cu(OH)2
(4)与钠反应:2─OH- H2
(5)与NaOH反应:一个酚羟基-NaOH;一个羧基-NaOH;一个醇酯-NaOH;一个酚酯-2NaOH;─X R─X-NaOH
③官能团的引入:
(1)引入C─C: C═C或-C≡-C与H2加成;
(2)引入 或-C≡C-:卤代烃或醇的消去;
或-C≡C-:卤代烃或醇的消去;
(3)苯环上引入
(4)引入─X:①在饱和碳原子上与X2(光照)取代;②不饱和碳原子上与X2或HX加成;③醇羟基与HX取代。
(5)引入─OH:①卤代烃水解;②醛或酮加氢还原;③C═C与H2O加成。
(6)引入─CHO或酮:①醇的催化氧化;②-C≡C-与H2O加成。
(7)引入─COOH:①醛基氧化;②─CN水化;③羧酸酯水解。
(8)引入─COOR:①醇酯由醇与羧酸酯化;②酚酯由酚与羧酸酐酯化。
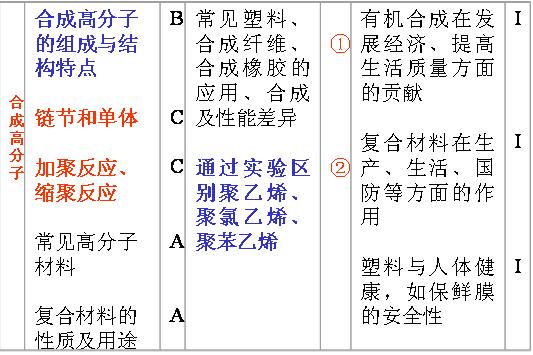
(9)引入高分子:①含 的单体加聚;②酚与醛缩聚、二元羧酸与二元醇(或羟基酸)酯化缩聚、二元羧酸与二元胺(或氨基酸)酰胺化缩聚。
的单体加聚;②酚与醛缩聚、二元羧酸与二元醇(或羟基酸)酯化缩聚、二元羧酸与二元胺(或氨基酸)酰胺化缩聚。
9、酯基:
水解
R─CO─O─ + 2NaOH→RCOONa+ ─ONa
8、羧基:
① 与Na,NaOH,Na2CO3,NaHCO3溶液反应
②酯化反应:
③酰胺化反应 R─COOH+H2N─R/→R─CO─NH─R/+H2O
7、醛基: 氧化与还原
检验①银镜反应;②与新制的Cu(OH)2悬浊液共热。
6、酚羟基:
①与Na,NaOH,Na2CO3反应
2 -OH+2Na→2 -ONa +H2↑
-OH +NaOH→ ─ONa +H2O
─OH +Na2CO3→ ─ONa +NaHCO3
注意:酚与NaHCO3不反应。
─ONa ─OH +NaHCO3(NaHSO3,Na+)
②苯酚在苯环上发生取代反应(卤代,硝化,磺化)的位置:邻位或对位。
检验遇浓溴水产生白色浑浊或遇FeCl3溶液显紫色;
5、醇羟基:①消去反应②氧化③与Na反应
多个羟基遇Cu(OH)2溶液呈绛蓝色 (葡萄糖)
4、R-X: ①消去反应②取代反应
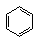
3、苯环:①取代(卤代,硝化,磺化);②加成(H2)
2、-C≡C-:①加成(H2、X2或HX、H2O);②加聚(单聚、混聚);③氧化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com