
1、我国自己设计安装的秦山核电站所用的燃料铀-235的氧化物23592 U16O2,1mol此氧化物中所含的中子数是阿伏加德罗常数的
A、153倍 B、159倍 C、267倍 D、151倍
3、“位--构--性”之间的关系
[分析] 分析讲解上表,指出学生在填表中的问题。
[例题]下列事实一般不能用于判断金属性强弱的是( )
A.金属间发生的置换反应
B. 1mol金属单质在反应中失去电子的多少
C.金属元素的最高价氧化物对应的水化物的碱性强弱
D.金属元素的单质与水或酸置换出氢的难易
[板书]四、练习
2、同周期或同主族元素性质的递变规律

1、周期表的结构

[例题]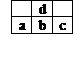 下图为周期表中短周期的一部分,若a原子最外层电子数比次外层电子数少3个,则下说法中不正确的是
下图为周期表中短周期的一部分,若a原子最外层电子数比次外层电子数少3个,则下说法中不正确的是
A、a、b、c最高价氧化物对应水化物的酸性强弱关系是c>b>a
B、a的氢化物比d氢化物移稳定
C、a和d的原子结合可以形成带3个负电荷的阴离子
D、原子半径大小顺序是c>b>d>a
3、原子半径总是由大到小,到稀有气体元素时半径突然增大,呈周期性变化;3、元素的主要化合价(最高正价与最低负价)均呈周期性变化。4、元素的金属性逐渐减弱,非金属性逐渐增强呈周期性变化。
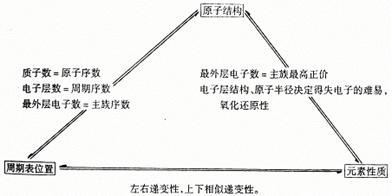
[引导] 为了很好地体现元素性质随着原子序数的递增而呈周期性变化的这个规律,在几代科学家的共同努力下,经过不断的完善和补充,编制了我们现今所用的元素周期表。下面,让我们从周期表中的周期、族,元素种类等方面来巩固一下对周期表结构的认识。
[板书]三、元素周期律与元素周期表的基础知识
第二课时
[引入] 上节课我们复习了原子结构的知识,本节课我们复习在此基础上归纳出来的元素周期律和元素周期表的有关知识。
[讨论]1、元素性质的周期性变化的实质是元素原子核外电子排布的周期性变化的必然结果。
2、素周期律主要包括哪些内容?
答:随着原子序数的递增:1、原子最外层电子数由1-2或1-8呈周期性变化;
21、短周期元素X、Y、Z组成的化合物Y2X和ZX2。Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX3。已知三种元素原子的质子总数为25,且Z和X的原子序数之和比X的原子序数2倍还多1,原子的最外层电子数是次外层电子数的2倍。试回答: (1)X、Y、Z元素的名称及符号。
(2)写出ZX2的化学式。
(3)Y2X对应水化物的电子式为 ,其中存在的化学键有 。
(4)写出Y2X溶于水的溶液与ZX2反应的化学方程式。
[小结] 本节课我们复习了原子结构,原子核外电子排布的规律及与之密切相关的一些概念。
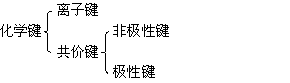
19、下说法不正确的是(D)
A.使干冰发生物理变化需克服范德华力
B.使干冰发生化学变化主要是破坏共价键
C.使氯化钠晶体发生化学反应需破坏离子键
D.化学键存在于原子之间,也存在于分子之间
[总结与板书]
[例题]20、推断下列微粒的名称,并用电子式表示其形成过程
(1)离子化合物AB,阳离子比阴离子多一个电子层,1molAB中含12mol电子,则该化合物名称 形成过程 。
(2)由第三周期元素的半径最大的阳离子和半径最小的阴离子形成的化合物 ,名称为 ,形成过程 。
18、在HF、H2O、NH3、CS2、CH4、N2分子中
①以非极性键结合的非极性分子是 N2
②以极性键结合,直线型结构的非级性分子是 CS2
③以极性键结合,具有正四面体结构的非级性分子是 CH4
④以极性键结合,具有三角锥形结构的极性分子是 NH3
⑤以极性键结合,具有V形结构的极性分子是 H2O
⑥以极性键结合,分子极性最大的是 HF
17、价化合物中元素化合价有正负的主要原因是(C)
A、电子有得失 B、共用电子对有偏移
C、电子既有得失又有电子对偏移 D、有金属元素的存在
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com