
23、(10分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
① c(Cl-)> c(NH4+)> c(H+)> c(OH-)
② c(NH4+)> c(OH-)>c(Cl-)> c(H+)
③ c(NH4+)> c(Cl-)> c(OH-)> c(H+)
④ c(Cl-) > c(H+) > c(NH4+)> c(OH-)
填写下列空白:
(1) 若溶液中只溶解一种溶质,则该溶质是_________ ,上述四种离子浓度的大小顺序为(填序号)____ ;
(2) 若四种离子的关系符合③,则溶质为______ __ _ ;
若四种离子的关系符合④,则溶质为______ ___ ;
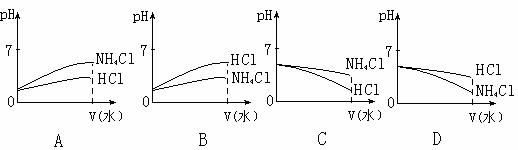
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图像正确的是(填图像符号) ;
(4) 若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
c(HCl) __ c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中
 c(H+)和碱中c(OH-)的关系为c(H+)_ ___ c(OH-)。
c(H+)和碱中c(OH-)的关系为c(H+)_ ___ c(OH-)。
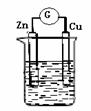
(5) 如右图所示,烧杯中盛放的溶液为盐酸, 接通电流表G后,
指针发生偏转,则负极材料是 ,正极反应式是
。
22、(11分)由短周期元素构成的常见离子,它们组成A、B、C、D四种物质,分别溶于水。已知:
①A、C的焰色反应呈黄色
②取A、B溶液,分别加入BaCl2溶液,均生成白色沉淀,再加入稀HNO3,A中沉淀溶解,并产生能使澄清石灰水变浑浊的无色、无臭气体,而B中无变化。
③在D的稀溶液中加入AgNO3溶液和稀HNO3,有白色沉淀生成。
④在D溶液中滴加C溶液,生成白色沉淀,继续滴入C,白色沉淀消失。
⑤A、B、C溶液的物质的量浓度相等,当A、B溶液以体积比1∶2混合时,生成无色气体;B、C溶液以体积比1∶2混合时,也生成无色气体,此气体能使湿润的红色石蕊试纸变蓝色;如果均以体积比1∶1混合,两者都不生成气体。
写出化学式:
A____________,B____________,C____________,D____________。
写出D溶液中不断滴入C溶液的离子方程式:________________________________________。
21、(9分)向某密闭容器中加人 0 . 3 molA 、 0 . 1 molC 和一定量的 B 三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示。附图中乙图为 t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,所用条件均不同。已知, t3 ~t4阶段为使用催化剂[已知 t0~ t1阶段 c ( B)未画出] 。
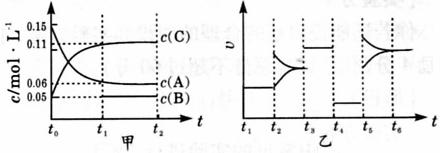
( 1 )若 t1= 15 s ,则t0~ t1阶段以 C 浓度变化表示的反应速率为v( C )=______________。
( 2 ) t4 ~t5阶段改变的条件为____________ , B 的起始物质的量为_________。
( 3 ) t5 ~t6阶段容器内 A 的物质的量共减少 0 . 03 mol ,而此过程中容器与外界的热交换总量为 akJ ,写出该反应的热化学方程式:
___________________________________ ;
20、(10分)下图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;IV、V、VI是气体收集装置,根据要求回答下列问题:
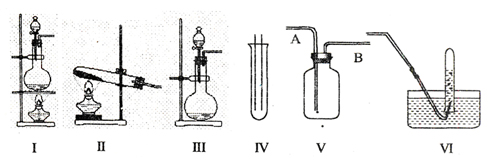
(1)若用MnO2与浓盐酸反应制取氯气,应选用装置 ,用方程式表示的制取氯气的反应原理是 _ ___ ___ ___ ___ 。
(2)若用KMnO4与浓盐酸反应制取氯气,应选用的装置 ,试完成并配平下列离子方程式:
MnO4-+ C1-+ H+- Mn2++
C12↑+ 。
(3)若选用IV为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用
溶液浸湿,其作用是 。
(4)若选用V为氯气收集装置,则氯气应从 口通入。用化学方法检验氯气收集满了的方法是 。
19、(4分)将3.48 g四氧化三铁完全溶解在100 ml、1 mol/L的硫酸中,然后加入K2Cr2O7溶液25 ml,恰好使溶液中的Fe2+全部转化为Fe3+,Cr2O72-全部转化成Cr3+,则K2Cr2O7的物质的量浓度为 mol/L
18、(8分)下列物质中含有极性键的是 ,含有非极性键的是 ,属于非极性分子的是 ,属于极性分子的是 。(用序号填空)
①CO2 ②H2O ③CH4 ④N2 ⑤H2 ⑥Na2O2 ⑦NaOH ⑧HF ⑨NH3
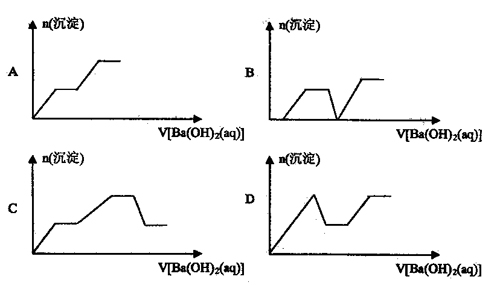
16、向一定体积含HC1、H2SO4、NH4NO、A1C13的混合溶液中逐滴加入Ba(OH)2溶液,溶液中产生沉淀的物质的量与加入Ba(OH)2溶液的体积关系正确的是 ( )
Ⅱ卷
15、常温下,Va L pH=2的盐酸与Vb L pH=12的氨水混合,若所得溶液显酸性,下列有关判断正确的是
A、Va 一定等于 Vb
B、Va 大于或等于 Vb
C、混合溶液中离子浓度一定满足: c(Cl-) > c(NH4+)> c(H+)> c(OH-)
D、混合溶液中离子浓度一定满足: c(NH4+) + c(H+) = c(Cl-)+ c(OH-)
14、现有浓度均为2 mol·L 的盐酸和硫酸溶液各100 mL,分别加入等质量的铁粉,反应结束后,测得生成的气体的质量比为2∶3,则加入铁粉的质量可能是
A.2.8 g B.5.6 g C.8.4 g D.16.8 g
13、从某些性质看,NH3与H2O相当,NH4+与H3O+相当,NH2-和OH-相当。下列有关化学方程式不正确的是:
A. 氯化铵与KNH2反应:NH4Cl
+ KNH2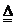 KCl + 2NH3↑
KCl + 2NH3↑
B. 二价活泼金属M(下同)与液氨反应:M + 2NH3 = M(NH2)2 + H2↑
C. 盐酸与MNH反应:2HCl + MNH = MCl2 + NH3 ↑
D. 氯化铵与MO反应:2NH4Cl + MO = M(NH2)2 + 2HCl + H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com