
1. 有15g A物质与10.5g B物质恰好完全反应,生成7.2gC物质、1.8g D物质和0.3mol E物质。则E物质的摩尔质量是 (A)27.5g (B)55 g·mol-1 (C)100mol (D)111g·mol-1
(1)不同类型的晶体:一般而言,熔、沸点高低顺序为原子晶体>离子晶体和金属晶体>分子晶体
(2)同类晶体:
①原子晶体的熔、沸点取决于共价键的键长和键能,键长越短、键越大,熔、沸点越高,如金刚石>金刚砂>晶体硅
②离子晶体的熔、沸点取决于离子键的强弱,通常离子半径越小、离子所带电荷数大,离子键越强,熔、沸点高,如KF>KCl>KBr、NaCl>KCl;
晶格能是指 形成1摩离子晶体释放的能量,通常取正值,晶格能越大,形成的离子晶体越 ,且熔沸点
③分子晶体的熔、沸点取决于分子间作用力的大小,通常分子极性越强、相对分子质量越大,分子间作用力越强,熔、沸越高,有氢键的分子晶体,还要考虑氢键的强弱
④同类金属晶体中,金属离子半径越小,阳离子带电荷数越高,金属键越强,熔、沸点越高,如Li>Na>K, Na<Mg<Al
试题枚举
[例1]晶体具有各向异性。如蓝晶石(Al2O3·SiO2)在不同方向上的硬度不同;又如石墨在与层垂直的方向上的导电率与层平行的方向上的导电率1∕104。晶体的各向异性主要表现在是:( )
①硬度 ②导热性 ③导电性 ④光学性质
A.①③ B.②④ C.①②③ D.①②③④
答案:D
[例2]下列属于分子晶体的一组物质是
A. CaO、NO、CO B .CCl4、H2O2、He
C .CO2、SO2、NaCl D .CH4、O2、Na2O
解析:固态金属是金属晶体;大多数的盐、碱和金属氧化物是离子晶体;熟记常见的原子晶体;其它常见物质大多是分子晶体
答案:B。
[例3]下列性质符合分子晶体的是
A . 熔点1070℃,易熔于水,水溶液能导电
B. 熔点是10.31℃,液体不导电,水溶液能导电
C. 熔点97.81℃,质软,能导电,密度是0.97g/cm3
D. 熔点973℃,熔化时能导电,水溶液也能导电
解析:A、D中的物质熔点较高,D中物质熔化时能导电,都是离子化合物;C中物质固态能导电,应为金属单质
答案:B
[例4]下列大小关系正确的是( )
A.晶格能:NaCl<NaBr B.硬度:MgO>CaO
C.熔点:NaI>NaBr D.熔沸点:CO2>NaCl
解析:离子半径 Cl-<Br- 离子键 NaCl>NaBr,晶格能NaCl>NaBr,A项错误;MgO、CaO均为离子晶体,离子半径Mg2+<Ca2+,MgO中离子键强,键能大,晶格能大,硬度大,B正确;C类似;D中CO2分子晶体,NaCl是离子晶体,熔沸点:CO2<NaCl
答案:B
[例5]金属能导电的原因是
A. 金属晶体中金属阳离子与自由电子间的相互作用较弱
B.金属晶体中的自由电子在外加电场作用下可发生定向移动
C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动
D.金属晶体在外加电场作用下可失去电子
解析:金属晶体中金属阳离子与自由电子间的相互作用属于静电作用,是强烈的相互作用,A错误;金属晶体在外加电场作用下电子定向移动,不会失去。
答案:B
[例6]现有甲、乙、丙、丁四种晶胞(如图所示),可推知:甲晶体中A与B的离子个数比为 ;乙晶体的化学式为 ;丙晶体的化学式为______;丁晶体的化学式为______。
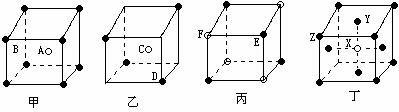
解析:立方晶胞体心的微粒一个晶胞所有,面心的微粒为两个晶胞是共有,每个微粒有1/2属于该晶胞,棱边的微粒为4个晶胞共有,每个微粒有1/4属于该晶胞,顶点的微粒为个8晶胞共有,每个微粒有1/8属于该晶胞。
答案:1∶1 C2D EF XY3Z
2.常见晶体的结构
 在金刚石的晶体结构中每个碳原子与周围的4个碳原子形成四个碳碳单键,这5个碳原子形成的是 结构,两个碳碳单键的键角为
,其中的碳原子采取 杂化,金刚石晶体中C原子数与C-C键数之比为 ,晶体中最小的环上上的碳原子数为 ;石墨晶体中C原子数与C-C键数之比为 ;NaCl晶体中Na+的配位数为 ,Cl-的配位数为 ,每个Na+的周围距离最近且相等的Na+的个数为 ,CsCl晶体中Cs+的配位数为 ,Cl-的配位数为 ,每个Cs+的周围距离最近且相等的Cs+的个数为 ;二氧化硅晶体中每个硅原子与 个氧原子相连,在二氧化硅晶体中最小的环中有 个原子,1mol二氧化硅晶体中,Si-O的数目为 。
在金刚石的晶体结构中每个碳原子与周围的4个碳原子形成四个碳碳单键,这5个碳原子形成的是 结构,两个碳碳单键的键角为
,其中的碳原子采取 杂化,金刚石晶体中C原子数与C-C键数之比为 ,晶体中最小的环上上的碳原子数为 ;石墨晶体中C原子数与C-C键数之比为 ;NaCl晶体中Na+的配位数为 ,Cl-的配位数为 ,每个Na+的周围距离最近且相等的Na+的个数为 ,CsCl晶体中Cs+的配位数为 ,Cl-的配位数为 ,每个Cs+的周围距离最近且相等的Cs+的个数为 ;二氧化硅晶体中每个硅原子与 个氧原子相连,在二氧化硅晶体中最小的环中有 个原子,1mol二氧化硅晶体中,Si-O的数目为 。
思考:右图是二氧化硅晶体的一部分,立方体体心的黑点表示一个硅原子,
在图中画出与硅原子相连的氧原子所在的位置。
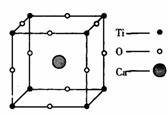
1.概念:描述 叫做晶胞;整块晶体由晶胞“无隙并置”而成;晶胞①中Ti、O、Ca原子数分别为 、 、 ;晶胞②中A、B、C、D原子数分别为 、 、 、 。
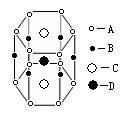
分子晶体中分子间尽可能采用紧密排列方式,分子的排列方式与其形状的关;离子晶体可视为不等径圆球的密堆积,离子晶体中正负离子的配位数主要由正负电荷的 (几何因素)、正负电荷的 (电荷因素)以及离子键的纯粹程度(键性因素)决定;金属晶体的结构可以归结为等径圆球的堆积,可分为Po的简单立方堆积、 型、 型和 型。
(1)晶体是内部微粒(原子、离子、分子)在空间按一定规则做 构成的 物质,晶体区别于非晶体的三个特征是:具有 的几何外形,各向 和具有固定的 。
(2)根据晶体内部微粒的 的微粒间 的不同可以将晶体分为通过离子键形成的 晶体,以金属键基本作用形成的 晶体,通过价键形成的 晶体和通过分子间相互作用形成的 晶体。
(3)常见晶体类型比较:
|
晶体类型 类型 比较 |
分子晶体 |
原子晶体 |
离子晶体 |
金属晶体 |
|
|
构成晶体 微粒 |
|
|
|
|
|
|
形成晶体微粒间作用力 |
|
|
|
|
|
|
作用力大小决定因素 |
|
|
|
|
|
|
物理性质 |
熔沸点 |
|
|
|
|
|
硬度 |
|
|
|
|
|
|
导电性 |
|
|
|
|
|
|
传热性 |
|
|
|
|
|
|
延展性 |
|
|
|
|
|
|
溶解性 |
|
|
|
|
|
|
典型实例 |
P4、干冰、硫 |
金刚石、SiO2 |
NaCl、KOH、NH4Cl |
金属单质 |
38.斐林试剂和班氏试剂有什么区别?
一个是碱性硫酸铜;另一个是柠檬酸纳,碳酸钠,硫酸铜混合物!
斐林试剂不稳定,不能长期保存,需临时配置;班氏试剂比较稳定,可以长久放置。
可测定还原性糖的浓度范围不同。
斐林的实验有效成发是Cu(OH)2,反应生成红色的Cu2O,原理相似。
37.为什么说人体内血钙过高导致肌无力,血钙过低会使人体发生抽搐现象
肌肉的收缩与舒张是相辅相成的两个过程,不能只有收缩没有舒张也不能只有舒张没有收缩。而且收缩和舒张都要适到好处,人的运动才能协调准确。
钙对于肌肉的作用是抑制肌肉收缩而促进它舒张。血钙过高时,对收缩的抑制过深,肌肉收缩就显得无力了;过低时,肌肉收缩过强而舒张不够,就出现了抽搐。
36.生长素和生长激素
生长素是植物激素,又名吲哚乙酸,是一种有机酸。产生的部位是叶原基、嫩叶和发育中的种子。分布的范围很广,主要集中在生长旺盛的部位,趋向衰老的组织和器官中很少。其生理作用是促进生长,促进枝条生根、发芽,促进果实发育,防止落花落果。生长素的生理作用还表现出两重性--高浓度抑制生长,低浓度促进生长。
生长激素是动物激素,其成分是一种蛋白质。是由动物的内分泌腺(垂体)分泌的一种激素,直接进入血液循环,随血液流向全身。其主要生理作用是促进生长,此外还能影响动物的糖类、脂类和蛋白质的代谢。
35.(1)叶绿体中光反应生成的ATP是否可以用于叶绿体外的生命活动?
叶绿体中光反应生成的ATP在叶绿体内只能用于暗反应,但如提取出来则可以。也可用细胞活动。
(2)光反应中水的光解到底需不需要酶。 不要。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com