
2.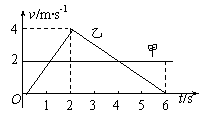 甲、乙两物体同时从同一地点沿同一方向做直线运动的速度-时间图象如图所示,则
(
)
甲、乙两物体同时从同一地点沿同一方向做直线运动的速度-时间图象如图所示,则
(
)
A.两物体两次相遇的时刻是2s和6s
B.4s后甲在乙前面
C.两物体相距最远的时刻是2s末
D.乙物体先向前运动2s,随后向后运动
1.下列关于速度与加速度的各种说法中,正确的是( )
A.速度越大,加速度越大 B.速度很大时,加速度可以为零
C.速度变化越大,则加速度越大 D.速度方向一定不能与加速度方向垂直
29. (10分)向100mL0.5mol·L-1的苛性钾溶液反应通入一定量的Cl2,在一下条件下充分反应后经检测溶液中含有ClO-与ClO3-的量之比为3:7,则参加反应的Cl2在标准状况下所占的体积是多少?
杭十四中2009学年第一学期高三化学月考(9月)试卷
28. (7分)CuO在高温时发生反应,生成氧化亚铜和氧气。若将500gCuO加热到1273K,当固体的含铜量为86%时,计算CuO的转化率。
27. (12分)某化学研究性学习小组探讨Fe3+和SO32--在溶液中之间发生怎样的反应,请你一起参与并协助他们完成实验。 (1)提出猜想: 甲同学认为发生氧化还原反应,其反应方程式为 ; 乙同学认为发生双水解反应,其反应方程式为2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3; (2)实验验证: 丙同学设计了下列实验来探究反应的可能性。 ①为了检验所用Na2SO3是否变质,应选用的试剂是 。 ②取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。 ③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。 (3)得出结论: ①根据丙同学的实验得出的结论是: ; ②实验③中溶液变成血红色的离子方程式为 。 (4)拓展探究: ①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是 。 ②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除SO32-水解能力较CO32-小外,还有 。
26. 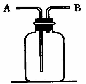 (7分)(1)下列实验操作或对实验事实的叙述中正确的是__
____(填序号)
A、测定硫酸铜晶体中结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量。
B、配制1 mol•L-1的NaOH溶液时,最后定容时仰视刻度线会造成所配溶液浓度偏高。
C、实验室配制FeCl2溶液时,将FeCl2固体先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉。
D、不用其它任何试剂也可鉴别下列四种溶液:Na2CO3、Al2(SO4)3、NaCl、NaHSO4。
E、可以用分液漏斗分离下列两组液态混合物:硝基苯和水、乙酸乙酯和乙醇。
(7分)(1)下列实验操作或对实验事实的叙述中正确的是__
____(填序号)
A、测定硫酸铜晶体中结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量。
B、配制1 mol•L-1的NaOH溶液时,最后定容时仰视刻度线会造成所配溶液浓度偏高。
C、实验室配制FeCl2溶液时,将FeCl2固体先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉。
D、不用其它任何试剂也可鉴别下列四种溶液:Na2CO3、Al2(SO4)3、NaCl、NaHSO4。
E、可以用分液漏斗分离下列两组液态混合物:硝基苯和水、乙酸乙酯和乙醇。
(2)下图所示装置有多种用途,请根据各用途回答下列问题: ①洗气:除去CO中的水蒸气,装置内应盛 ; ②检验:证明CO中混有CO2,装置内应盛 ; ③集气:若用排空气法收集比空气重的气体,气体应从装置的 端通入(填A或B,下同),若用排水法收集O2时,瓶内应先装满水,气体从 端通入; ④贮气:若要用水将装置中的氧气排出进行实验时,水应从 端通入; ⑤量气:若要测定实验室制得的少量O2的体积,则应在瓶内先装满水,再将O2从 端通入。
25. (4分)已知HCO3-比HBrO更难电离,但HBrO的酸性弱于H2CO3,请写出以下反应的离子方程式: (1)向NaHCO3溶液中滴加少量溴水: (2)向Na2CO3溶液中滴加少量溴水:
24. (4分)CO与PdCl2溶液反应产生黑色金属钯粉末,反应中有水参加,利用此反应可用氯化钯(PdCl2)检测CO对大气的污染情况,此反应的化学方程式为 ,反应中CO具有 性。
23. (4分)在一定条件下,RO3n-与I-发生反应离子方程式如下: RO3n- + 6I-+ 6H+ == R- + 3I2 + 3H2O (1)RO3n-中R元素的化合价是 (2)R原子的最外层电子数是
22. (6分)若某Na2CO3溶液中含有mmolNa2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-与HCO3-的物质的量之比为2:1,则滴入的盐酸的物质的量为 ,请写出相关的化学方程式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com