
26.  (7分)(1)下列实验操作或对实验事实的叙述中正确的是__
____(填序号)
A、测定硫酸铜晶体中结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量。
B、配制1 mol•L-1的NaOH溶液时,最后定容时仰视刻度线会造成所配溶液浓度偏高。
C、实验室配制FeCl2溶液时,将FeCl2固体先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉。
D、不用其它任何试剂也可鉴别下列四种溶液:Na2CO3、Al2(SO4)3、NaCl、NaHSO4。
E、可以用分液漏斗分离下列两组液态混合物:硝基苯和水、乙酸乙酯和乙醇。
(7分)(1)下列实验操作或对实验事实的叙述中正确的是__
____(填序号)
A、测定硫酸铜晶体中结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量。
B、配制1 mol•L-1的NaOH溶液时,最后定容时仰视刻度线会造成所配溶液浓度偏高。
C、实验室配制FeCl2溶液时,将FeCl2固体先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉。
D、不用其它任何试剂也可鉴别下列四种溶液:Na2CO3、Al2(SO4)3、NaCl、NaHSO4。
E、可以用分液漏斗分离下列两组液态混合物:硝基苯和水、乙酸乙酯和乙醇。
(2)下图所示装置有多种用途,请根据各用途回答下列问题: ①洗气:除去CO中的水蒸气,装置内应盛 ; ②检验:证明CO中混有CO2,装置内应盛 ; ③集气:若用排空气法收集比空气重的气体,气体应从装置的 端通入(填A或B,下同),若用排水法收集O2时,瓶内应先装满水,气体从 端通入; ④贮气:若要用水将装置中的氧气排出进行实验时,水应从 端通入; ⑤量气:若要测定实验室制得的少量O2的体积,则应在瓶内先装满水,再将O2从 端通入。
25. (4分)已知HCO3-比HBrO更难电离,但HBrO的酸性弱于H2CO3,请写出以下反应的离子方程式: (1)向NaHCO3溶液中滴加少量溴水: (2)向Na2CO3溶液中滴加少量溴水:
24. (4分)CO与PdCl2溶液反应产生黑色金属钯粉末,反应中有水参加,利用此反应可用氯化钯(PdCl2)检测CO对大气的污染情况,此反应的化学方程式为 ,反应中CO具有 性。
23. (4分)在一定条件下,RO3n-与I-发生反应离子方程式如下: RO3n- + 6I-+ 6H+ == R- + 3I2 + 3H2O (1)RO3n-中R元素的化合价是 (2)R原子的最外层电子数是
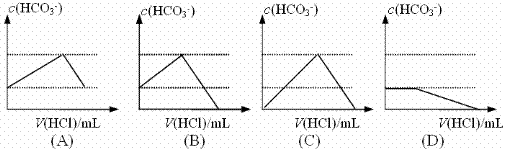
22. (6分)若某Na2CO3溶液中含有mmolNa2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-与HCO3-的物质的量之比为2:1,则滴入的盐酸的物质的量为 ,请写出相关的化学方程式
21. (6分)有A、B、C、D四种无色溶液,分别是CH3COONa溶液、NH4Cl溶液、盐酸和Na2SO4溶液中的一种。已知A、B的溶液中水的电离程度相同,A、C溶液和pH相同。A是___________溶液,B是_____________溶液,C是____________溶液。
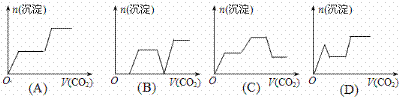
20. 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的体积的关系可表示为
19. 某浓度下Na2CO3饱和溶液的质量分数为a%,向其中加入mmolNa2CO3·5H2O或nmol Na2CO3,可析出相同质量的 Na2CO3·10H2O,则下列叙述正确的是 (A)a%可能为40%,m>n (B)a%可能为40%,m=n (C)a%可能为30%,m>n (D)a%可能为30%,m<n
18. 向浓度均为0.01mol/L的Na2CO3和NaHCO3混合溶液中逐滴加入0.01mol/L的稀盐酸,直到不再生成CO2为止,在此过程中,溶液中HCO3--浓度变化情况最有可能是下列图中的(假设溶液体积可以相加)
17. 已知一份K2CO3样品中含Na2CO3、KNO3、Ba(NO3)23种杂质中的一种或两种。将7.8g样品溶于足量的水中,得到澄清溶液。若再加入过量CaCl2溶液,可得到5.0g沉淀,则原样品所含的杂质中 (A)肯定有Na2CO3,没有Ba(NO3)2 (B)肯定有 KNO3, 没有 Ba(NO3)2,可能还有Na2CO3 (C)肯定没有Na2CO3、Ba(NO3)2 (D)无法断定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com