
例1 利用凝胶色谱法,什么样的蛋白质先洗脱出来( )
A.相对分子质量大的
B.溶解度高的
C.相对分子量小的
D.所代电荷多的
解析:凝集色谱法使根据相对分子质量的大小分离蛋白质的有效方法。相对分子质量较小的蛋白质能进入凝胶内部通道,路程较长,移动速度较慢;相对分子质量大的蛋白质,路程较短,移动速度较快,首先洗脱出来。
答案:A
例2 蛋白质提取和分离分为哪几步( )
A.样品处理、凝胶色谱操作、SDS-聚丙烯酰胺凝胶电泳
B.样品处理、凝胶色谱操作、纯化
C.样品处理、粗分离、纯化、纯度鉴定
D.样品处理、纯化、粗分离、纯度鉴定
解析:蛋白质的提取和分离分为样品处理、粗分离、纯化、纯度鉴定四步。A中凝胶色谱操作及SDS-聚丙烯酰胺凝胶电泳为实验操作过程中的技术
答案:C
☆综合应用
例3用凝胶色谱法分离蛋白质时,分子量大的蛋白质( )
A路程较长,移动速度较慢 B路程较长,移动速度较快
C路程较短,移动速度较慢 D路程较短,移动速度较快
解析:在小球体内部有许多贯穿的通道,当相对分子质量不同的蛋白质通过凝胶时,相对分子质量较小的蛋白质容易进入凝胶内部的通道,路程较长,移动速度较慢;而相对分子质量较大的蛋白质无法进入凝胶内部的通道,只能在凝胶外部移动,路程较短,移动速度较快。
答案:D
2.4如何除无机盐离子和小分子有机物质呢?。
透析。半透膜的选择透过性,大分子物质不能通过半透膜,离子和小分子能够通过半透膜。
在透析过程中,血红蛋白溶液中的离子和小分子不断通过半透膜扩散进入到pH=7的磷酸缓冲液中。
思考:为何使用pH=7的磷酸缓冲液?为什么缓冲液量远多于血红蛋白溶液量?
维持血红蛋白的正常特性。有利于杂质分子充分地向外扩散。
总结:通过以上四个基本过程,红细胞中的血红蛋白就被提取出来。但其中还含有其他种类的蛋白质分子(如呼吸酶等)。怎样将杂蛋白与血红蛋白分离开来呢?我们来研究蛋白质提取和分离的第二个步骤――粗分离(凝胶色谱操作)。
2.3从红细胞中分离出血红蛋白的过程为:洗涤红细胞、释放血红蛋白、分离血红蛋白、透析。洗涤红细胞的目的是什么?
除去血浆蛋白的杂蛋白,有利于后续步骤的分离纯化。
红细胞的洗涤过程为
血液+柠檬酸钠→低速短时离心→吸出上层血浆→红细胞+5倍体积生理盐水 →缓慢搅拌10min→低速短时离心→吸出上清液→反复洗涤直至上清液无黄色
思考:加入柠檬酸钠有何目的?为什么要低速、短时离心?为什么要缓慢搅拌?
防止血液凝固;防止白细胞沉淀;防止红细胞破裂释放出血红蛋白。
思考:你有什么方法将红细胞中的血红蛋白释放出来?
加入蒸馏水,用玻璃棒快速搅拌一段时间。
补充:加入蒸馏水后红细胞液体积与原血液体积要相同。加入甲苯的目的是溶解细胞膜,有利于血红蛋白的释放和分离。此时,红细胞破碎混合液中不仅含有血红蛋白,而且还含有细胞破碎物、脂质、甲苯有机溶剂等。怎样除去这些杂质呢?由于它们的密度不同,科学家采取了离心分离的方法:
红细胞破碎混合液→中速长时离心(2000c/min×10min)→滤纸过滤除去脂质→分液漏斗分离出血红蛋白
2.1蛋白质的提取和分离一般分为哪些基本步骤?
样品处理、粗分离、纯化、纯度鉴定。
思考:是否所有种类的蛋白质的提取和分离都是这样的?为什么?
不是。因为蛋白质的来源和性质不同,分离方法差别很大。
2.实验设计
1.2缓冲溶液
(1)原理:由弱酸和相应的强碱弱酸盐组成(如H2CO3-NaHCO3,HC-NaC,NaH2PO4/Na2HPO4等),调节酸和盐的用量,可配制不同pH的缓冲液。
(2)缓冲液作用:抵制外界酸、碱对溶液pH的干扰而保持pH稳定。
1.1凝胶色谱法(分配色谱法):
(1)原理:(见课件图) 分子量大的分子通过多孔凝胶颗粒的间隙,路程短,流动快;分子量小的分子穿过多孔凝胶颗粒内部,路程长,流动慢。
(2)凝胶材料:多孔性,多糖类化合物,如葡聚糖、琼脂糖。
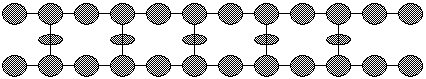
(3)分离过程:
混合物上柱→洗脱→大分子流动快、小分子流动慢→收集大分子→收集小分子
*洗脱:从色谱柱上端不断注入缓冲液,促使蛋白质分子的差速流动。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com