
特别提示:都选不得分,选做一个并且正确,得7分
选作(一)
已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层
数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三
倍,Y和Z可形成两种以上的气态化合物。则:
(1)X是 、Y是 、Z是
(2)由Y和Z组成的,Y和Z的质量比为7:20的化合物的化学式
(3)由X、Y、Z中两种元素组成,且与X2Z分子具有相同的电子数的两种
离子是 和
(4)X、Y、Z可形成一种盐,此盐中X、Y、Z的原子个数比为4:2:3,
则该盐的化学式为:
选作(二)
已知: 相对分子质量46,相对分子质量88。
相对分子质量46,相对分子质量88。
 (不稳定,R代表烃基)
(不稳定,R代表烃基)
从A出发合成F的流程如下,且A~F是只含C、H、O三种元素的化合物,有关它们的某些信息,已注明在下面的方框内。
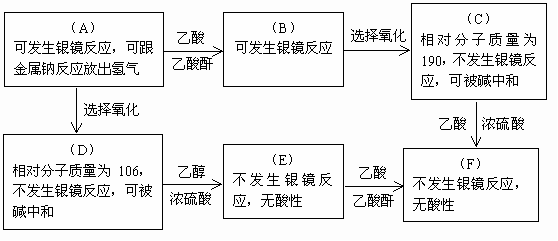
回答下列问题:
(1)根据以上信息分析A中含有_____________(填官能团的名称和数目);
并确定A、F的结构简式是
(2)写出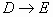 变化的化学方程式
变化的化学方程式
(3)在化合物A~F中具有酯的结构的化合物是(填写字母代号)____________
26、已知:FeS存在着溶解平衡:FeS(s)  Fe2+
(aq)+S 2-(aq),
Fe2+
(aq)+S 2-(aq),
在常温下,Ksp(FeS)==8.1×10-17mol2/L2,
(1)理论上FeS的溶解度为:
(2)H2S的饱和溶液中存在着以下关系:[H+]2×[S2- ]=1.0×10-22,为了使溶液中的[Fe2+]达到1.0mol/L,现将适量的FeS投入到其饱和溶液中,应调节溶液的[H+]=
25、(10分)在a、b两支试管中,分别放入形态相同、质量相等的一颗锌粒,然后向两支试管中,分别加如PH相同、体积相同的盐酸和醋酸。填写下列空白:
(1)a、b两支试管中的现象:
相同点是:
不同点是:
导致上述现象中现象不同点的原因是
(2)假设锌粒过量,a、b两支试管中最终生成气体的体积关系是
原因:
24、(5分)ZnCl2固体中含有Fe3+ Fe2+ Cu2+ 和Br - 等杂质,试用最简单的方法除去其中的杂质。实验步骤为:第一步是将固体溶于水,加入 ,再过滤,可除去 离子,第二步是向滤液中加入 ,可除去 离子;第三步
23、(6分)右图是某温度时,在容
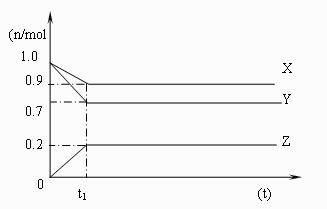 积为1L的容器中X、Y、Z三
积为1L的容器中X、Y、Z三
种物质的物质的量随时间的变
化曲线,根据图中的曲线变化
情况可知:
(1)t1点表示的意义是:
(2)t1时刻之前各物质的浓度变化情况:
(3)试写出该反应的化学方程式:
22、(10分)实验室中制备氯气的原理是:MnO2和浓盐酸,在加热的条件下反应原理方程式:MnO2 + 4HCl(浓) 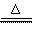 MnCl2
+ Cl2↑+ 2H2O
MnCl2
+ Cl2↑+ 2H2O
分析回答下列问题:
(1)该反应属于离子反应,请写出该反应的离子方程式:
(2)从化合价变化的角度分析,该反应属于氧化-还原反应,其中,氧化剂是 、还原剂是 、氧化产物是 、还原产物是
(3)根据上述反应方程式得知,当有4molHCl参加反应时,有 molHCl发生氧化反应,生成 molCl2。
(4)比较Cl2和空气的密度大小 ,你的理由是:
,
所以,如果采用排空取气法收集气体,应当采用 。
21、(5分)锌锰干电池是用锌制圆筒为外壳,石墨碳棒上盖铜冒在中央,筒中填充NH4Cl和淀粉糊作为电解质,同时还填入MnO2和炭黑,故称为锌锰干电池。回答下列问题:
(1)判断该电池的正负极:
正极: 、负极:
(2)电池的总反应式为:Zn+2NH4++2MnO2=Zn2++2NH3+Mn2O3+H2O
则两个电极的电极反应式分别是:
正极: 、负极:
(3)该类电池用久了会变形外鼓、漏液,请解释:
20、在1L浓度为c mol/L的弱酸HA中,HA、A-和H+的物质的量之和为nc mol,
则HA的电离度是 ( )
A、100n% B、c/n×100% C、100(n-1)% D、n%
山东省新泰市高三开学考试
化 学 试 题
第Ⅱ卷 非选择题部分(50分)
19、下列说法中正确的是 ( )
A、所有的物质都存在化学键
B、在同一个分子中所有的原子之间都存在化学键
C、没有化学键就不会存在化合物
D、化学反应中,不一定破坏化学键
18、将铁钉和碳棒用导线连接后,同时浸入0.01mol/L的NaCl溶液中,可能发生的反应是 ( )
A、碳棒上放出氢气 B、碳棒附近产生OH-
C、碳棒上放出氧气 D、铁钉被氧化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com