
1.分子动理论
例题1.已知水的密度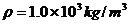 ,其摩尔质量
,其摩尔质量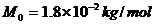 ,阿伏加德罗常数
,阿伏加德罗常数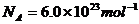 。试求:
。试求:
⑴某人一口喝了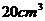 的水,内含多少水分子?
的水,内含多少水分子?
⑵估计一个水分子的线度多大?
解析:水的摩尔体积是
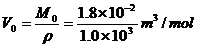
⑴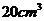 中的水含有的分子数为
中的水含有的分子数为
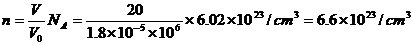
⑵把水分子看成“球体”,并设其直径为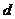 ,则有
,则有
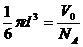
所以 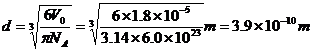
知识链接:
①“物质是由大量分子组成的”,这是分子动理论的第一个内容;
②除一些有机物大分子以外,多数分子大小的数量级为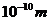 。处理有关分子大小的计算问题时,一般可以将分子看成“球体”模型或“立方体”模型。上题的第二问中,若把分子看成“立方体”,就可以用表达式
。处理有关分子大小的计算问题时,一般可以将分子看成“球体”模型或“立方体”模型。上题的第二问中,若把分子看成“立方体”,就可以用表达式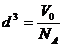 求得分子的线度为
求得分子的线度为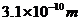 。可见,不管把分子看成什么模型,求得的分子大小的数量级都是
。可见,不管把分子看成什么模型,求得的分子大小的数量级都是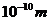 。一般情况下,在估算固体或液体分子线度、分子间的距离时采用“球体”模型,而在估算气体间距或分子所占空间大小时采用“立方体”模型。
。一般情况下,在估算固体或液体分子线度、分子间的距离时采用“球体”模型,而在估算气体间距或分子所占空间大小时采用“立方体”模型。
③若设物质的摩尔质量为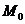 ,摩尔体积为
,摩尔体积为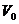 ,密度为
,密度为 ,分子质量为
,分子质量为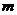 ,分子体积为
,分子体积为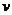 ,阿伏加德罗常数为
,阿伏加德罗常数为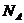 ,则有
,则有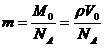 ,
,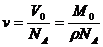 。这是几个常用的表达式,要熟悉并记住它们。从中可以看出:阿伏加德罗常数
。这是几个常用的表达式,要熟悉并记住它们。从中可以看出:阿伏加德罗常数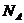 是联系宏观量(
是联系宏观量(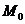 、
、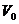 和
和 )和微观量(
)和微观量(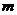 和
和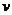 )的桥梁。若再知道物质的质量
)的桥梁。若再知道物质的质量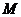 和体积
和体积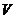 ,还可以求出所含有的分子数目
,还可以求出所含有的分子数目 等等。
等等。
 例题2.如图1所示是教材中模仿布朗实验所做的一个类似实验中,记录的其中一个小炭粒的“运动轨迹”。以小炭粒在
例题2.如图1所示是教材中模仿布朗实验所做的一个类似实验中,记录的其中一个小炭粒的“运动轨迹”。以小炭粒在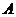 点开始计时,图中的
点开始计时,图中的 、
、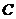 、
、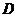 、
、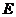 、
、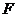 、
、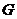 ……各点是每隔
……各点是每隔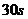 小炭粒所到达的位置,用折线连接这些点,就得到了图中小炭粒的“运动轨迹”。则下列说法中正确的是
小炭粒所到达的位置,用折线连接这些点,就得到了图中小炭粒的“运动轨迹”。则下列说法中正确的是
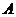 .图中记录的是分子无规则运动的情况
.图中记录的是分子无规则运动的情况
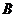 .在第
.在第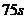 末,小炭粒一定位于
末,小炭粒一定位于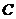 、
、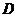 连线的中点
连线的中点
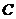 .由实验可知,小炭粒越大,布朗运动越显著
.由实验可知,小炭粒越大,布朗运动越显著
 .由实验可知,温度越高,布朗运动越剧烈
.由实验可知,温度越高,布朗运动越剧烈
解析:首先要弄清楚的是:此实验用显微镜观察的是悬浮在液体中小炭粒的运动,而不是液体分子的运动,更不是小炭粒分子的运动,所以选项 是错误的;再者,图中
是错误的;再者,图中 、
、 、
、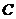 、
、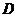 、
、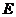 、
、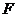 、
、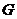 ……各点是每隔
……各点是每隔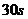 小炭粒所到达的位置,连线是人为画出的,只是用来表示小炭粒到达各位置的先后顺序,并不能说明小炭粒是沿着连线运动的,更不能说明小炭粒是以等速率运动的,所以选项
小炭粒所到达的位置,连线是人为画出的,只是用来表示小炭粒到达各位置的先后顺序,并不能说明小炭粒是沿着连线运动的,更不能说明小炭粒是以等速率运动的,所以选项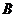 也是错误的;由实验可知,小炭粒越小或温度越高,布朗运动越显著,所以选项
也是错误的;由实验可知,小炭粒越小或温度越高,布朗运动越显著,所以选项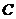 错、
错、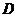 对。
对。
本题的正确答案为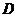 。
。
知识链接:
①“组成物质的分子永不停息地做无规则热运动”,这是分子动理论的第二个内容。
②除扩散现象能够说明组成物质的分子的无规则运动外,布朗运动也充分证实了物质分子的无规则运动。但这里需要强调的是,实验中观察到的是悬浮在液体中颗粒的运动,并没有观察到分子的运动,布朗运动指的就是悬浮颗粒的的运动,是通过观察悬浮颗粒的无规则运动,来证实液体分子无规则运动的!一定不要稀里糊涂得出错误结论,更不能因为看题不仔细而选错了答案。
③颗粒越小或温度越高,其周围液体分子的对其撞击作用的不平衡性越明显,布朗运动也就越显著;布朗运动越显著,也就反映了分子的运动越剧烈;由于分子运动剧烈程度与温度有关,所以把分子的无规则运动叫做热运动。
例题3.关于分子势能,下列说法中正确的是
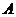 .分子间表现为斥力时,分子间距离越小,分子势能越大
.分子间表现为斥力时,分子间距离越小,分子势能越大
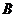 .分子间表现为引力时,分子间距离越小,分子势能越大
.分子间表现为引力时,分子间距离越小,分子势能越大
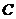 .当分子间距离
.当分子间距离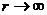 时,分子势能最小
时,分子势能最小
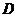 .将物体以一定的初速度竖直向上抛出,在物体的上升阶段,其分子势能越来越大
.将物体以一定的初速度竖直向上抛出,在物体的上升阶段,其分子势能越来越大
解析:分子间表现为斥力时,分子间距离越小,需要克服分子间的斥力做功,所以分子势能增大,选项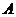 正确;分子间表现为引力时,分子间距离越小,是分子引力对分子做功,从而分子势能减小,选项
正确;分子间表现为引力时,分子间距离越小,是分子引力对分子做功,从而分子势能减小,选项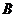 错误;只有当
错误;只有当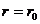 时,分子势能才最小,所以选项
时,分子势能才最小,所以选项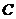 错误;物体上升增加的是其本身的重力势能,与分子势能无关,所以选项
错误;物体上升增加的是其本身的重力势能,与分子势能无关,所以选项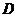 也是错误的。
也是错误的。
本题的正与其答案为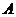 。
。
知识链接:
①“分子间存在着相互作用的引力和斥力”,这是分子动理论的第三个内容。
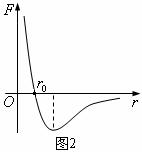 ②分子力
②分子力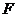 (分子引力和斥力的合力)表现为引力还是斥力,取决于分子间的距离。如图2画出了分子力
(分子引力和斥力的合力)表现为引力还是斥力,取决于分子间的距离。如图2画出了分子力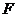 随分子间距离
随分子间距离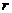 而变化的图象,由图象可知,分子间的距离
而变化的图象,由图象可知,分子间的距离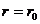 (
(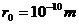 ,下同)时,分子力
,下同)时,分子力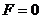 ,分子间的距离
,分子间的距离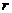 >
>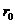 时,分子力
时,分子力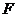 表现为引力,并且随着
表现为引力,并且随着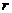 的增大,
的增大,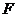 先增大后减小;分子间的距离
先增大后减小;分子间的距离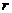 <
<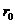 时,分子力
时,分子力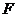 表现为斥力,并且随着
表现为斥力,并且随着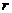 的减小,
的减小,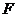 一直增大。
一直增大。
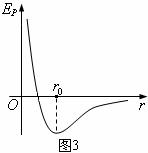 ③分子间由于存在着相互的引力和斥力,所以分子所组成的系统具有势能,即分子势能。分子势能的大小是由分子间的作用力和它们之间的相对位置所决定的。若取分子相距无穷远时势能为零,则分子势能
③分子间由于存在着相互的引力和斥力,所以分子所组成的系统具有势能,即分子势能。分子势能的大小是由分子间的作用力和它们之间的相对位置所决定的。若取分子相距无穷远时势能为零,则分子势能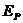 随分子间距离
随分子间距离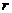 而变化的关系图象如图3所示。由图象可知,分子间的距离
而变化的关系图象如图3所示。由图象可知,分子间的距离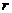 >
>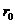 时,
时, ;分子间的距离
;分子间的距离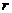 <
<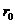 时,
时, ;分子间的距离
;分子间的距离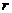 =
=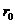 时,分子势能
时,分子势能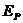 最小。即,分子势能的变化直接与分子力做功有关系。
最小。即,分子势能的变化直接与分子力做功有关系。
④要注意宏观量和微观量之间的关系:物体的机械能和内能是两个不同的物理量,它们分别从宏观和微观两个不同方面描述物体的能量,但它们之间没有丝毫的必然联系,决不能说物体的机械能大其内能就一定越大,象上面题目中的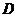 选项。
选项。
例题4.某种油的浓度为每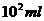 的溶液中有
的溶液中有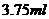 的油,密度
的油,密度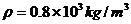 ,摩尔质量
,摩尔质量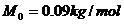 。用注射器量得
。用注射器量得 上述溶液共有
上述溶液共有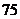 滴,将其中的
滴,将其中的 滴滴在水面上形成单分子油膜,油膜面积
滴滴在水面上形成单分子油膜,油膜面积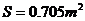 。试根据以上数据粗略测定出阿伏加德罗常数
。试根据以上数据粗略测定出阿伏加德罗常数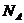 。(要求保留一位有效数字)
。(要求保留一位有效数字)
解析:这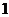 滴溶液中含有的油的体积为
滴溶液中含有的油的体积为
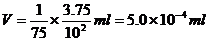
油分子的直径为

一个油分子的体积分别为
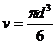
这种油的摩尔体积为
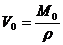
所以,阿伏加德罗常数为
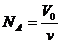
代入数据,解得
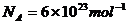
命题解读:
分子大小可以用单分子油膜法测定,这个题目其实是单分子油膜实验的一个变形应用,这种方法只能粗测。为了使结果更加精确一些,在实验过程中,一方面,要尽量使滴在水面上的油尽量扩散开,形成“单分子油层”;另一方面,在利用坐标纸确定单分子油膜的面积时,一般采用“小于半格不计,大于半格计整格”的四舍五入法。另外,在书写结果时一定要注意题目要求,像本题要求保留一位有效数字。
、 相同的分子具有相似的化学键特征,它们的许多性质是相近的,这叫做等电子原理。
试题枚举
[例1]关于化学键的下列叙述中,正确的是
A.离子化合物中可能含有共价键
B.共价化合物中可能含有离子键
C.离子化合物中只含离子键
D.共价键只能存在于化合物中
解析:离子键只存在于离子化合物中,共价键可存在于离子化合物、共价化合物以及某些单质中
答案: A
[例2]下列化合物中既存在离子键,又存在极性键的是
A.H2O B.NH4Cl C.NaOH D.Na2O2
解析:水分子中只有H-O键,是极性键,无离子键,排除A项;NH4Cl中NH4+和Cl-间是离子键,NH4+内N和H原子以极性键结合,B项正确;NaOH中Na+和OH-以离子键结合,OH-内H和O之间以极性键结合,C项正确;Na2O2中Na+和O22-以离子键结合,O22-内有非极性键,排除D项。
答案:B C。
[例3]下列分子中所有原子都满足最外层8电子结构的是
A.光气(COCl2) B.六氟化硫 C.二氟化氙 D.三氟化硼
解析:分子中的原子是否满足8电子结构,决定于中心原子的最外层电子数和形成共价键的数目
答案:A
[例4]对δ键的认识不正确的是( )
A.δ键不属于共价键,是另一种化学键
B.S-Sδ键与S-Pδ键的对称性相同
C.分子中含有共价键,则至少含有一个δ键
D.含有π键的化合物与只含δ键的化合物的化学性质不同
解析:共价键包括δ键和π键,δ键不管是S-Sδ键、S-Pδ键还是P-Pδ键都是轴对称的,π键不够稳定,必须与δ键共存
答案:A
[例5]下列分子中,键能最小的是
A.F2 B.Br2 C.Cl2 D.N2
解析:N2中含有一个三键,键能较大;F2、Br2、Cl2中只有一个单键,键能小,F2分子中电子“密度”大,F原子间斥力大,键能最小
答案:A
[例6]能够用键能解释的是( )
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液体,碘为固体
C.稀有气体一般很难发生化学反应
D.硝酸易挥发,硫酸难挥发
解析:键能的大小影响键的稳定性,影响的是物质的化学性质(稳定性)
[例7]与NO3-互为等电子体的是( )
A.SO3 B.BF3 C.CH4 D.NO2
解析:等电子体要求原子总数相同、价原子总数相同,C、D原子总数不同,A价原子总数不同,选B
答案:B
键参数包括 、 、 ;其中 、 是衡量共价稳定性的参数,通常键长越 ,键能越大,表明共价键越稳定;共价键具有 性, 是描述分子立体结构的重要参数,分子的立体结构还与 有一定的关系。
 非极性共价键: 元素的原子间形成的共价键,共用电子对 偏向任何一个原子,各原子都
,简称
非极性共价键: 元素的原子间形成的共价键,共用电子对 偏向任何一个原子,各原子都
,简称
极性共价键: 元素的原子间形成的共价键,共用电子对偏向电负性 较 的一方,简称
 δ键:δ键的特征:以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形不变,这种特征称为
。常见的δ键有“s-sδ键”、
、
。
δ键:δ键的特征:以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形不变,这种特征称为
。常见的δ键有“s-sδ键”、
、
。
π键:π键呈 对称,常见的有“ π键”
思考:如何判断δ键和π键?δ键和π键的稳定性如何?
2.写出下列微粒的电子式:Al Mg2+ O2- OH- NH4+ CaCl2 CO2
2、离子键与共价键比较
|
键型 |
离子键 |
共价键 |
|
(1)概念 |
|
|
|
(2)成键微粒 |
|
|
|
(3)形成条件 |
|
|
|
(4)用电子式表示形成过程 |
|
|
思考:1.离子键、共价键分别存在于哪些种类的物质中?
1、概念: ,叫做化学键,根据成键原子间的电负性差值可将化学键分为 和 。旧的化学键的断裂和新的化学键的生成是化学反应的本质,也是化学反应中能量变化的根本。
125、 获得产物的方法 获得微生菌体是通过过滤,沉淀
获得产物的方法 获得微生菌体是通过过滤,沉淀
获得代谢产物是通过蒸馏、萃取、离子交换
124、高压蒸汽灭菌法:1/5 1/2 2/3 75% 由里向外、细密、不重复
熔化后分装前必须要调节pH 无菌箱 ↑
细菌培养的过程:培养基的配制→灭菌→搁置斜面→接种→培养观察
123、影响微生物生长的环境因素
pH值:影响酶的活性、细胞膜的稳定性,从而影响微生物对营养物质的吸收
温度:影响酶和蛋白质的活性
O2浓度 产甲烷杆菌
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com