
2. 锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还
原的硝酸的物质的量为
A.2 mol B.1 mol C.0.5 mol D.0.25 mol
[解析]:此题主要考查氧化还原反应的配平:配平后的化学方程式为:4Zn+10HNO3(稀)===4Zn(NO3)2+NH4NO3+3H2O,当生成1mol的Zn(NO3)2时,被还原的HNO3为0.25mol。答案D。
[随堂训练][1-8为单选,9-10为双选]
1.从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2 +12H2O====7Cu2S+5FeSO4 +12H2SO4。下列说法正确的是
A. Cu2S既是氧化产物又是还原产物 B. 5 mol FeS2发生反应,有10 mol电子转移
C. 产物中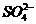 有一部分是氧化产物
D. FeS2只作还原剂
有一部分是氧化产物
D. FeS2只作还原剂
[解析]分析反应

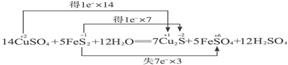
可知,FeS2中S的化合价降低生成Cu2S,升高生成FeSO4,故FeS2既是氧化剂又是还原剂,D错误;CuSO4中Cu的化合价降低生成Cu2S,FeS2中S的化合价也降低生成Cu2S,故Cu2S只是还原产物,非氧化产物,A错误;5 mol FeS2发生反应,有21 mol 电子转移,B错误;产物中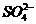 有一部分是氧化产物,另一部分由CuSO4提供,C正确。
有一部分是氧化产物,另一部分由CuSO4提供,C正确。
4、根据氧化还原反应去书写未知的化学方程式是2010年必不可少的题目,关键是解题方法:依据题意列出主要反应物和生成物→化合价升降法使电子守恒→观察法配平并补全缺的物质。
[典例精析][《学海导航》p8 例2 、3 p9 2、3]
2、要明确解题的方法思路:理清概念抓实质,解题应用靠特征,即从氧化还原反应的实质电子转移,去分析理解有关概念,而在实际解题过程中,应从分析元素化合价有无变化这一氧化还原反应的特征入手。具体思路是:找变价、判类型、分升降、定其他。其中“找变价”是非常关键的一步,特别是反应物中含有同种元素的氧化还原反应,必须弄清它的变化情况。3、对于重点规律(守恒律、强弱律、价态律、先后律、归中律等)要通过典型习题来熟悉。
1、要理清两条知识主线,即升(化合价)→失(电子)→氧(反应)→还(剂应)→氧(产物)及降→得→还→氧→还。抓住两个相等:得失电子总数、化合价升降总数相等(电子守恒)。
22.已知命题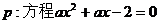 在[-1,1]上有解,命题q:只有一个实数x满足:
在[-1,1]上有解,命题q:只有一个实数x满足:
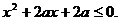
(1)若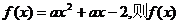 的图象必定过两定点,试写出这两定点的坐标
的图象必定过两定点,试写出这两定点的坐标
(只需填写出两点坐标即可);
(12)若命题“p或q”为假命题,求实数a的取值范围。
21.旅游部门开发一种旅游纪念品,每件产品的成本是15元,销售从是20元,月平均销售a件。通过改进工艺,产品的成本不变,质量和技术含量提高,市场分析的结果表明,如果产品的销售价提高的百分率为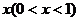 。那么月平均销售量减少的百分率为
。那么月平均销售量减少的百分率为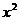 。改进工艺后,旅游部门销售该纪念品的平均利润是y(元)。
。改进工艺后,旅游部门销售该纪念品的平均利润是y(元)。
(1)写出y与x的函数关系式;
(2)改进工艺后,确定该纪念品的售价,使旅游部门销售该纪念品的月平均利润最大。
20.在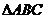 中,角A、B、C所对的边分别为a,b,c,设S为
中,角A、B、C所对的边分别为a,b,c,设S为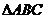 的面积,满足
的面积,满足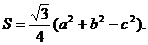
(1)求角C的大小;
(2)求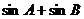 的最大值。
的最大值。
19.已知函数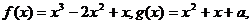 若函数
若函数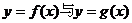 的图像有三个不同的交点,求实数a的取值范围。
的图像有三个不同的交点,求实数a的取值范围。
18.设函数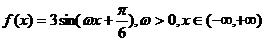 ,且以
,且以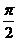 为最小正周期。
为最小正周期。
(1)求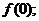
(2)求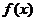 的解析式;
的解析式;
(3)已知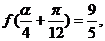 求
求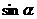 的值。
的值。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com