
10.钢铁“发蓝”是在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可以用如下化学方程式表示:
① 3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑;
② 6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+ NH3↑+7NaOH;
③ Na2FeO2+ Na2Fe2O4+2H2O=Fe3O4+4NaOH;
 下列说法正确的是
下列说法正确的是
A.该生产过程不会产生污染 B.反应①②中的氧化剂均为NaNO2
C.反应①②③均是氧化还原反应 D.四氧化三铁具有抗腐蚀作用
11(1)2009年9月至今,我国各个地区也接连暴发甲型H1N1流感疫情,防控
专家表示,含氯消毒剂和过氧化物消毒可防甲型H1N1流感。二氧化氯 是目前国
是目前国
际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与
Na2SO3反应制得。
请写出反应的离子方程式: 。
(2)漂白剂亚氯酸钠(NaClO2)在常温黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1molHClO2发生分解反应时,转移的电子个 数是
。
数是
。
(3)有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原
反应中的反应物和生成物,则该反应中还原剂与氧化剂的物质的量之比
为 。
(4)完成下列方程式:
3Fe+1NO-2+ OH--FeO2-2+1H2O 。
9.Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中不正确的是
A.Na2O2在反应中只作氧化剂
B.O2是氧化产物
C.Na2FeO4既是氧化产物又是还原产物
D.有2mol FeSO4参加发生反应时,反应中共有8mol电子转移
8.将质量为m g的铁粉与铜粉的混合物,溶于100mL 4mol·L-1 HNO3溶液(过量),充分反应后所得还原产物为0.05mol NO,再向所得溶液中加入足量的NaOH溶液至沉淀完全,则沉淀质量为
A.5.52g B. (m+6.8)g C.(m+2.55)g D.(m+12.0)g
7. 已知:①2BrO3-+Cl2=Br2+2ClO3-②5Cl2+I2+6H2O=2HIO3+10HCl③ClO3-+
5Cl-+6H+=3Cl2↑+3H2O,下列按物质氧化性顺序由强到弱排列正确的是
A. Cl2>BrO3->ClO3->IO3- B. BrO3->ClO3->Cl2>IO3-
C. ClO3->BrO3->IO3->Cl2 D. BrO3->Cl2>ClO3->IO3-
6. 某反应体系中的物质有NaOH、Au2O3,Na2S4O6,Au2O,H2O,Na2S2O3。
Au2O3为反应物,则下列有关说法正确的是
A.该反应体系中有三种元素的价态发生了变化
B.Au2O在反应中作还原剂
C.Na2S4S6发生还原反应
D.1molAu2O3发生反应,转移电子4moL
5.根据下表信息,下列叙述中正确的是
|
序号 |
氧化剂 |
还原剂 |
其他反应物 |
氧化产物 |
还原产物 |
|
① |
Cl2 |
FeBr2 |
|
|
Cl- |
|
② |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
Mn2+ |
|
③ |
KClO3 |
浓盐酸 |
|
Cl2 |
|
|
④ |
KMnO4 |
浓盐酸 |
|
Cl2 |
Mn2+ |
 A.表中①组反应的氧化产物只能有FeCl3
A.表中①组反应的氧化产物只能有FeCl3
B.氧化性强弱比较:KMnO4>Fe3+>Cl2>Fe2+
C.④的离子方程式配平后,H+的化学计量数为16
D.表中③还原产物是KCl
4.三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3 NF3 + 5 H2O = 2 NO + HNO3 + 9 HF。下列有关该反应的说法正确的是
A.NF3是氧化剂,H2O是还原剂
B.还原剂与氧化剂的物质的量之比为2:1
C.若生成0.2 mol HNO3,则转移0.2 mol电子
D.NF3在潮湿的空气中泄漏会产生红棕色气体
3.下列叙述正确的是
A. 元素的单质一定由氧化或还原该元素的化合物制得
B. 含有最高价元素的化合物不一定具有很强的氧化性
C. 阳离子只能得到电子被还原,阴离子只能失去电子被氧化
D. 在化学反应中,得电子越多的氧化剂,其氧化性就越强
2.工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
⑴4FeO·Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
⑵2Na2CrO4+H2SO4
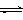 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是
A.反应⑴和⑵均为氧化还原反应
 B.反应⑴的氧化剂是O2,还原剂是FeO·Cr2O3
B.反应⑴的氧化剂是O2,还原剂是FeO·Cr2O3
C.高温下,O2的氧化性大于Fe2O3小于Na2CrO4
D.生成1mol的Na2Cr2O7时共转移7mol电子
1. 为预防“H1N1”甲型流感,同学们每天用“84”消毒液(NaClO溶液)消毒,下列说法正确的是
A.NaClO溶液的消毒原理是使蛋白质变性
B.1molCl2与足量NaOH溶液反应转移2mol电子
C.NaClO溶液的漂白原理与Na2O2、SO2相同
D.“84”消毒液与“洁厕灵”(盐酸)共同使用,可达到既清洁又消毒的双重效果
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com