

3.圆周运动中的追及问题
以前所涉及的追及问题,物体都是在一条直线上运动的,其实在曲线运动中也存在着物体之间的追及现象。
例题4.甲、乙两运动员在同一圆形轨道上从同一地点同时沿同一绕向进行比赛,可认为甲、乙二人做的都是匀速圆周运动,若甲的周期为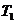 ,乙的周期为
,乙的周期为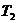 ,并且
,并且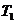 >
>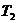 。试求:经过多长时间甲、乙两运动员相距最远?经过多长时间他们相距最近?
。试求:经过多长时间甲、乙两运动员相距最远?经过多长时间他们相距最近?
解析:设从开始运动经过时间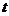 甲、乙两运动员相距最远,依题意,这时他们一定是在圆形轨道同一直径的两端,则有
甲、乙两运动员相距最远,依题意,这时他们一定是在圆形轨道同一直径的两端,则有
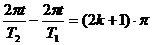 ,
,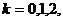 ……
……
解得 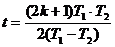 ,
,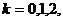 ……
……
即,经过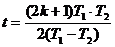 两运动员相距最远。
两运动员相距最远。
同理,若设经过时间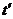 两运动员相距最近的话,则有
两运动员相距最近的话,则有
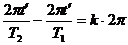 ,
,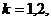 ……
……
解得 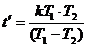 ,
,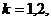 ……
……
即,经过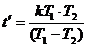 两运动员相距最近。
两运动员相距最近。
命题解读:这是一个在同一圆形轨道上的两物体间的追及问题,两者相距最远时一定在同一直径的两端,相距最近时一定在同一地点,解决的关键是考虑他们各自与圆心的连线所转过的角度关系。其实在做完这道题目之后,可以思考下面的两个问题:
①若要求两者相距最远或最近的最少时间呢?
②若题目中两运动员分别是在同心、但半径不相等的两个圆形轨道上呢?何时两者相距最远?何时两者又相距最近呢?
2.圆周运动中向心力来源问题
⑴匀速圆周运动中向心力来源
例题2.下图1中的四种情况中,各质点都在作匀速圆周运动,分别指出向心力来源(填在相应的空格处)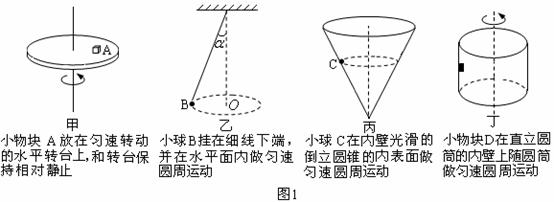
图甲中是____、____和____的合力提供小物块 所需要的向心力;
所需要的向心力;
图乙中是____和____的合力提供小球 所需要的向心力;
所需要的向心力;
图丙中是____和____的合力提供小球 所需要的向心力;
所需要的向心力;
图丁中是____、____和____的合力提供小物块 所需要的向心力。
所需要的向心力。
答案:图甲中:重力、支持力和静摩擦力;
图乙中:重力和绳的拉力;
图丙中:重力和支持力;
图丁中:重力、支持力和静摩擦力。
⑵非匀速圆周运动中向心力来源
例题3.在如图2所示的两种情况中,分析向心力来源并填写在横线上:
图甲中,悬挂在细线下端的小球以速度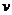 经过图中的位置时,是____力和____力在绳方向上的合力提供小球所需要的向心力。
经过图中的位置时,是____力和____力在绳方向上的合力提供小球所需要的向心力。
 图乙中,水平向右的匀强电场中,带负电的小球沿竖直放置的光滑轨道上升,以速度
图乙中,水平向右的匀强电场中,带负电的小球沿竖直放置的光滑轨道上升,以速度 经过图中的位置时,是____力、____力沿轨道半径方向上的分力和____力的合力提供小球所需要的向心力。
经过图中的位置时,是____力、____力沿轨道半径方向上的分力和____力的合力提供小球所需要的向心力。
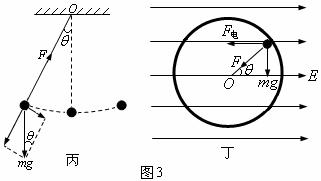 解析:如图3所示的丙和丁分别为甲、乙两图中小球的受力示意图,由圆周运动知识可知,丙图中是由绳的拉力和重力沿绳方向上分力的合力提供小球所需要的向心力;而丁图中则是由重力、电场力分别沿轨道半径方向上的分力和轨道的压力这三者的合力提供小球所需要的向心力。
解析:如图3所示的丙和丁分别为甲、乙两图中小球的受力示意图,由圆周运动知识可知,丙图中是由绳的拉力和重力沿绳方向上分力的合力提供小球所需要的向心力;而丁图中则是由重力、电场力分别沿轨道半径方向上的分力和轨道的压力这三者的合力提供小球所需要的向心力。
答案 图甲中:绳的拉力 重力;图乙中:重力、电场力、轨道的压力。
可见,在匀速圆周运动中,是所有外力的合力提供了物体做匀速圆周运动所需要的向心力;而在变速圆周运动中,是所有外力在半径方向上的分力的合力提供物体所需要的向心力。对变速圆周运动,切线方向上的合力使物体产生了切线方向上的加速度,因此线速度大小是变化的。
1.圆周运动中的速度及加速度
⑴速度:对于一般的圆周运动而言,线速度的大小是变化的,方向也在时刻变化;而对于匀速圆周运动来讲,仅仅是线速度的方向在变。所以,匀速圆周运动是“匀速率圆周运动”;所有的圆周运动都是变速运动,做圆周运动的物体一定具有加速度。
⑵加速度:对于匀速圆周运动而言,物体所具有的加速度一定指向圆心,所以叫做向心加速度;而对于做一般的圆周运动的物体来讲,加速度可以分解为半径方向上的加速度----向心加速度和切线方向上的加速度,向心加速度改变线速度的方向,切线方向上的加速速度用来改变线速度的大小。
例题1.下列说法中正确的是
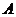 .圆周运动中的加速度一定指向圆心
.圆周运动中的加速度一定指向圆心
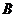 .做匀速圆周运动的物体,其线速度一定不变
.做匀速圆周运动的物体,其线速度一定不变
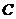 .做匀速圆周运动的物体,其角速度一定不变
.做匀速圆周运动的物体,其角速度一定不变
 .在变速圆周运动中,向心加速度不一定改变物体线速度方向
.在变速圆周运动中,向心加速度不一定改变物体线速度方向
答案: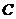
 V气体(标准状态)(L)
V气体(标准状态)(L)

 粒子数(N)
物质的量(n)
物质的质量(g)
粒子数(N)
物质的量(n)
物质的质量(g)
V溶液(L)
请你将上述关系图的转化方法标出来。
试题枚举
[例1]如果我们规定12C的相对原子质量为24,且0.024kg12C中所含的原子个数为阿伏加德罗常数(NA),那么下列几种物理量会有变化吗?若有,请说明变化结果。
(1)一个12C原子的质量 (2)阿伏加德罗常数(NA) (3)摩尔质量
(4)O2的相对分子质量
(5)气体摩尔体积
(6)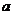 g C2H5OH的物质的量
g C2H5OH的物质的量
(7)98%(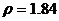 )硫酸的物质的量浓度
(8)44gCO2所含的分子个数
)硫酸的物质的量浓度
(8)44gCO2所含的分子个数
解析:(1)在规定12C的相对原子质量为24时,实际上是把作为相对原子质量的标准从原来用12C质量的1/12,改为1/24,但是单个碳原子的质量并没有因此而发生改变;
(2)原来是以0.012kg12C所含有的碳原子数作为阿伏加德罗常数(即6.02×1023),现在用0.024kg12C中所含的原子个数为阿伏加德罗常数(NA),很明显0.024kg12C中所含的原子个数是0.012kg12C中所含的原子个数的2倍;故阿伏加德罗常数(NA)变为原来阿伏加德罗常数的2倍(即2×6.02×1023);
(3)原来所称摩尔质量,实质上是指1摩尔物质的质量即6.02×1023个微粒集体的质量,当作出了上述规定后,1摩尔所含的粒子数已经变成了原来的2倍,故其质量也就为原来的2倍;
(4) 原来氧分子的相对分子质量=氧分子的质量/12C质量的1/12,现在氧分子的相对分子质量=氧分子的质量/12C质量的1/24,即作为相对原子质量的标准变为了原来的一半,而氧分子的质量是固定的,故氧分子的相对分子质量变为原来的2倍;
(5)气体摩尔体积是指在一定的温度和压强下, 阿伏加德罗常数个气体分子所占有的体积,由于阿伏加德罗常数已经变成了原来的2倍,气体摩尔体积当然也就是原来的2倍了;
(6)根据公式:物质的量(n)=物质的质量(m)/物质的摩尔质量(M),在新的条件下由于摩尔质量变成了原来摩尔质量的2倍,等质量的物质的“物质的量”则等于原来的一半;
(7) 溶质的物质的量浓度(CB)=溶质的物质的量(n)/溶液的体积(V),在单位体积的98%(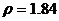 )硫酸中所含溶质--硫酸的质量是不变的,但由(6)中所述可知,其物质的量(n)变成了原来的一半,故物质的量浓度变为原来的0.5倍;
)硫酸中所含溶质--硫酸的质量是不变的,但由(6)中所述可知,其物质的量(n)变成了原来的一半,故物质的量浓度变为原来的0.5倍;
(8) 不论作为相对原子质量的标准如何变化,单个CO2分子的质量并未变化,故一定质量的CO2所含的分子个数是不会发生变化的。
答案:(1)不变(2)变为原来的2倍(3)变为原来的2倍(4)变为原来的2倍(5)变为原来的2倍(6)变为原来的0.5倍(7)变为原来的0.5倍(8)不变
[例2]下列说法中,正确的是( )
A.KOH的摩尔质量是56g B.一个碳原子的质量就是其相对原子质量
C.硫原子的质量就是硫的相对原子质量
D.氦气的摩尔质量在数值上等于它的相对原子质量
解析:摩尔质量的单位应当是g/mol,而不是g,故A不对;碳原子的相对原子质量是指拿一个碳原子质量除以一个12C原子质量的1/12所得的比值;硫原子的质量除以一个12C原子质量的1/12所得的比值才是硫的相对原子质量,所以B、C均不对;
答案D
[变式]在一定条件下,16g A和20g B恰好反应生成4.5g D和C。在相同条件下,8g A与15g B反应可生成0.125mol C和D。从上述事实中可推知C的分子量为 。
解析: 根据质量守恒定律可知,16g A和20g B恰好反应时生成4.5g D和31.5gC;在相同条件下,8g A与15g B反应(根据上述反应中A和B的比例关系可知B是过量的)时则应当生成 15.75gC,题目给出的是生成0.125mol C,根据摩尔质量(M)=物质的质量(g)/物质的“物质的量(n)”,可以计算出M=126g/mol,所以C的相对分子质量为126。
[例3]用NA表示阿佛加德罗常数,下列说法中正确的是( )
A.1mol甲烷的质量与NA个甲烷分子的质量之和相等
B.28g氮气与40g氩气所含的原子数目相等,都是NA个
C.2.3g钠由原子变成离子,失去的电子数为0.1NA
D.18g重水(D2O)所含的电子数为10NA
解析:]根据摩尔的定义,每摩尔物质含有阿伏加德罗常数(NA)个微粒,所以A组答案是正确的,氮气是双原子分子,而氩气是单原子分子,28g氮气所含有的原子数为2NA个,40g氩气所含的原子数目是NA个;一个钠由原子变成离子时,将会失去1个电子,2.3g钠为0.1mol,由原子变成离子时失去的电子数为0.1NA;18g重水(D2O)所含的分子为0.9mol,而每个分子所含的电子数为10个,所以18g重水(D2O)所含的电子数为9NA;故答案为AC
[变式](1)(NH4)2SO4的摩尔质量为 。现有26.4g(NH4)2SO4,则其中含有 molH, 个氧原子、 mol质子;它溶于水时能电离产生 mol铵根离子,这么多铵根离子的质量是 。
(2)计算10克下列物质的“物质的量”(保留小数点后两位)
NaHCO3 SO3
(3)计算出下列物质的质量0.2mol Na2CO3 ;0.3mol NH4HCO3
(4)26.4g(NH4)2SO4中硫元素的质量与 g NaHCO3中所含氧元素的质量相等;与 g NaHCO3中所含的氢原子个数相等。
[例4]有一真空储气瓶,净重500克。在相同条件下,装满氧气后重508克,装满另一种气体X时重511克,则X的相对分子质量为( )
A. 44 B. 48 C. 64 D. 71
解析:本题题给条件应当说是“同温、同压、同体积(同一个真空瓶)”,所以不论装什么气体,里面所含气体的物质的量是相同的,根据物质的量(n)=物质的质量(m)/物质的摩尔质量(M)可以得到计算式:(508-500)/32=(511-500)/ M,所以M=44。
答案:A
[变式]标准状况下,mg气体A与ng气体B所含分子数相同,下列说法不正确的是
A. A与B相对分子质量之比为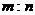
B. 同质量的A与B所含分子数之比为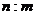
C. 相同状况下,同体积的A与B的质量之比为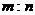
D. 标准状况下,A与B的密度之比为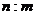
答案:D
[例5]配制250 mL 1.6mol/L NaCl溶液。具体步骤如下:
(1)计算:需 gNaCl。(2)称量:使用的主要仪器是 。
(3)溶解:将称好的NaCl放在 中加适量蒸馏水溶解,并用 加以搅拌。
(4)转移:待溶液冷却到室温后,将其沿玻璃棒注入 中,其中玻璃棒的作用是 。
(5)洗涤:将烧杯和玻璃棒用蒸馏水洗涤 次,并将每次洗涤后的溶液都注入中;其主要目的是 。
(6)定容:将蒸馏水注入 中,直到其中液面接近其刻度 处时,改用 滴加蒸馏水至溶液的 液面正好与刻度线相切。将瓶塞子盖好,反复上下颠倒、摇匀。
[变式1]在配制物质的量浓度溶液时,下列操作出现的后果是(填:“溶液浓度不准确”、“偏低”、“偏高”、“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体。_____________。
(2)配制氢氧化钠溶液时,溶液不能澄清,溶质少量不溶解。____________。
(3)配制氯化钠溶液时,容量瓶中有少量水。______________。
(4)定容时,液面上方与刻度相齐时,停止加水。__________。
(5)配制好溶液后,容量瓶未塞好,洒出一些溶液。_____________。
(6)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线____________。
答案:(1)偏低 (2)偏低 (3)无影响 (4)偏高 (5)无影响 (6)偏低
[变式2]实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取的Na2CO3质量分别为( )
A. 1000mL , 212g B. 950mL , 201.4g C. 500mL , 286g D. 1000mL, 201.4g
解析:由于容量瓶的规格中不可能有950mL,只能选择略大于所需溶液体积的规格(即1000mL),计算溶质的质量时也就按1000mL溶液中所含的溶质。
答案:A
6.以单位 溶液里所含 B的 来表示溶液组成的物理量,叫B的物质的量浓度。符号为 ,常用的单位是 (或 )。
[课堂练习]
(1)2gNaOH溶于水配制成 mL溶液时其物质的量浓度为2mol/L。
(2)现欲配制200mL0.2mol/L Na2SO4溶液,则需要用 mL 1mol/L的Na2SO4溶液加水稀释而成。从稀释而成的溶液中取出10 mL则其中含有的钠离子是 个。
(3)把2.24LHCl气体溶于水,配制成250mL溶液,则该溶液的物质的量浓度为 ,若其密度为1.1g/mL,则其溶质的质量分数是 %。
5.在相同的 和 下,相同体积的任何 都含有 的粒子。
[讨论]下列有关气体的叙述中,错误的是( )
A. 不同的气体,若体积不同,则它们所含的分子数肯定不同
B.当分子数目相同时,气体体积的大小主要决定于气体分子之间的距离
C. 一定温度和压强下,气体分子的物质的量决定了它们的体积
D. 在标准状况下,的混合物
[课堂练习](1)标准状况下:22g CO2的体积是 ,其中所含分子数与 gO2相同。
(2)0.01 mol某气体的质量是0.28g,该气体的摩尔质量是 ;在标准状况下,
该气体的密度是 。
(3)相同条件下,CH4与O2的质量比是1:8时二者的体积比是 。
4.物质体积的大小取决于构成这种物质的 、 和
这三个因素。 叫气体摩尔体积,用符号 表示,常用的单位有 (或)和 。通常将 ℃、 Pa时的状况称为标准状况。标准状况下的气体摩尔体积为 。
中所含的碳原子总数为A
3.1mol任何粒子集合体都含有 个粒子;而任何粒子或物质的质量在
以 为单位时,其数值都与该粒子的 或 相等。
将 叫做摩尔质量。摩尔质量的符号
为 ,单位常用 或 。
物质的量(n)、物质的质量(m)、摩尔质量(M)三者之间的关系式是: n=
2.1mol任何粒子集体所含的粒子数与0.012kg 中所含的原子数相等,约
为 ,把 叫做 常数,并作为一个 ,符号为 。物质的量只适用于微观粒子,使用摩尔作单位时,必须指明粒子的种类并且要用化学式来表示。
[讨论]下列说明是否正确?为什么?
(1)0.5mol氧气 ;(2)0.2mol氢分子 ;
(3)0.3mol钠离子 ;(4)10mol氮 ;
(5)4 mol苹果 。
1.1971年,在第十四届国际计量大会上决定用 作为计量原子、分子或离子等微
观粒子的“物质的量”的单位。“物质的量”的符号为 ,实际上表示含有一定数目 的
集合体。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com