
4.下列说法不正确的是
①将CO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成
②将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,两者放出的氢气质量相等
A.只有② B.①②③ C.①③④ D.①②③④
3.下列说法正确的是
A.工业用SiO2与焦炭制取单质硅过程中,生成的气体产物是CO
B.硫在空气中燃烧的产物是SO2,在纯净氧气中燃烧的产物是SO3
C.钠在敞口容器中长期存放和在空气中燃烧的产物都是Na2O2
D.镁在空气中和纯净氧气中燃烧的产物都只有MgO
2. 符合实际并用于工业生产的是
A.工业上冶炼铁:2Fe2O3
+3C 3CO2
+4Fe B.H2和Cl2光照制HCl
3CO2
+4Fe B.H2和Cl2光照制HCl
C.Cl2通入澄清石灰水中制漂粉精 D.用硫铁矿石制硫酸
1. 下稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:①铈常见的化合价为+3和+4;②氧化性:Ce4+>Fe3+。下列说法正确的是
A. 、
、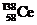 、
、 、
、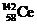 它们互称为同素异形体
它们互称为同素异形体
B.工业上可以采用电解氯化铈水溶液来获得铈单质
C.铈溶于氢碘酸的主要化学方程式可表示为:2Ce+6HI=2CeI3+3H2↑
D.工业上金属铈一般保存在敞口容器中
2.下列金属冶炼的反应原理,错误的是
 A.2NaCl(熔融)通电2Na+Cl2↑ B.MgO+H2△Mg+H2O
A.2NaCl(熔融)通电2Na+Cl2↑ B.MgO+H2△Mg+H2O
C.Fe3O4+4CO高温3Fe+4CO2 D.2HgO△2Hg+O2↑
[方法要领]热还原法主要适合中等活泼的金属,如Zn-Cu。注意还原性的强弱和化学平
衡原理的使用。如MgO不能用H2还原,因为Mg的还原性强于H2,但是可以用C来还原,
如.MgO+C = Mg+CO反应条件是高温,此时产物Mg和CO均是气体。答案B 。
[随堂训练][1-6为单选,7-8为双选]
1.广东正在建设海洋强省。下列说法不正确的是
A. 从海带中提取碘单质的过程涉及氧化还原反应
B. 往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输
 C. 赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的
C. 赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的
D. 海洋经济专属区的资源开发可获得Fe、Co、K、Au、Mg、B等金属
[方法要领]海水中含碘含的是碘离子(I-),要从海水中提取碘单质(I2)必然会涉及到元素化合价的升降所以一定涉及氧化还原反应,故A正确;赤潮主要是由生活污水和工农业生产的废水任意排放引起水中 N、P元素增高造成水域的水富营养化而造成的,故C正确;由于岩石、大气、生物的相互作用,B不是金属元素,故D不正确。
3、复习建议
(1)依靠理论指导,减轻记忆负担。元素化合物知识虽然内容繁多,但其中有许多内容和化学基本理论紧密联系在一起,复习时时应运用化学理论去指导、统帅、掌握元素化合物知识,而不要死记硬背。
(2)建立知识结构网络,理清知识体系。元素化合物知识虽然内容繁多,易学难记,但将知识结构化、网络化、系统化,可事半功倍。
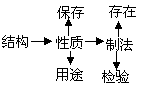 (3)抓住重点,带动全局。专题复习时应抓住重点,每族元素要抓住代表物,并注意该族元素与其代表物在结构、性质上的相似性、递变性和特殊性。
(3)抓住重点,带动全局。专题复习时应抓住重点,每族元素要抓住代表物,并注意该族元素与其代表物在结构、性质上的相似性、递变性和特殊性。
[典例精析]
2、考查角度:
(1)以卤素知识为载体,考查应用基本概念、基本理论的能力,其中以氧化还原反应为重点,ClO-的强氧化性、水解为命题的热点。
(2)考查硫的化合物(SO2、硫酸盐、硫酸)的性质、有关氧化还原反应知识的计算、SO2的制备、SO42- 、H2O2、O3 的性质。
(3)C、CO、CO2、和CO2、HCO3-、CO32-的转化关系及有关实验和计算。
(4)以氮氮及其化合物知识为背景,考查氧化还原反应、物质的推断、化工生产和环境保护的相关知识。
(5)铁铝一直是高考命题的核心内容之一,铝的两性、铁的变价尤其是Al3+、Al(OH)3、AlO2-三者之间的转化条件及应用,Fe2+与Fe3+之间的转化条件及利用;铁的几种有特殊颜色的物质的应用等,仍是高考试题中的“常青树”。
(6)从比较Na、Al、Mg、Fe与酸反应的有关量值关系或将金属性质与原电池、电解池工作原理结合起来进行命题的可能性较大;仍会以极大的热情关注金属在环境污染、科技发展、生产生活在的体现。
1、考点阐释:
(1)以氯为例,了解卤素元素的物理、化学性质,了解次氯酸的重要性质的用途;掌握漂白粉的组成、性质和应用;掌握Cl-、Br-、I-的检验。
(2)其它常见的非金属元素(H、O、S、N、P、C、Si)了解常见元素的单质的氢化物、氧化物的重要性质、并进行比较;掌握硫酸、硝酸的制备原理、性质、用途;了解磷酸、硅酸的主要性质和用途;了解硫、氮、碳的氧化物对大气的污染,以及防止大气污染;了解常见盐类的性质和用途;了解环境保护的有关知识。
(3)单质钠与溶液反应;Na2O2的性质尤其是与CO2、H2O的反应;NaOH性质(与酸式盐、CO2反应产物分析,在有机物水解中的应用);Na2CO3、NaHCO3的性质、相互转化及应用等。
(4)镁单质的性质,第ⅠA、ⅡA族元素性质的相似性与递变性。
(5)铝、Al2O3、Al(OH)3的两性,铝盐与强碱、偏铝酸盐与强酸的反应(现象、产物种类、离子方程式),Al、Al2O3、Al(OH)3、AlO2-、Al3+五种形态之间的相互转化的基本途径。
(5)铁的性质及不同价态间的相互转化(尤其是Fe2+、Fe3+间的转化),Fe2+、Fe3+的鉴别与转化。
(7)金属的通性、冶炼原理、腐蚀与防护,金属与工业生产、生活、科技发展等的联系。
3.以上各部分知识的综合应用
[高考预测][《学海导航》p101 2 p106 9]
预计2010年高考,元素及其化合物将重点考查组合型选择题以及以元素化合物知识为载体的工艺流程、实验、计算,其中渗透考查应用基本概念、基本理论的能力、其中以氧化还原反应为重点、水解为命题的热点。在复习中要注意物理性质、用途、制备及化学方程式。
此外,联系社会,以化工生产中的新工艺、新方法为切入点,单质及其化合物知识为出
发点进行综合能力考查。关注人与自然的和谐发展,考查环境保护的相关知识。
[学法导航]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com