
12.
 以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:
以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:
|
已知:① 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
② 部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表
|
沉淀物 |
Cu(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
|
开始沉淀pH |
4.7 |
2.7 |
7.6 |
|
完全沉淀pH |
6.7 |
3.7 |
9.6 |
(1)试剂a是 ,试剂b是 。(写名称)
(2)操作X应为蒸发浓缩、 、 。
(3)反应Ⅱ中加CuO调pH为3.7-4的目的是 ;
(4)反应Ⅴ的离子方程式为 。
10.已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石。有人设计了把我国的贫菱锰矿(MnCO3含量较低)转化为高品位“菱锰矿砂”(MnCO3含量高)的绿色工艺。该工艺流程如下图所示:

已知焙烧反应①的化学方程式:
(NH4)2SO4+MnCO3MnSO4+2NH3↑+CO2↑+H2O。
(1)写出反应②的离子方程式_______________________________________。
(2)上述工艺流程中,可以循环利用的物质有(NH4)2SO4、___ ___、_______。从物料平衡角度看,理论上生产过程中______(填“需要”或者“不需要”)添加(NH4)2SO4。
(3)向物质的量浓度均为0.01 mol·L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的是___________(填离子符号);当两种沉淀共存时,溶液中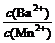 =__________。
=__________。
[已知Ksp(BaCO3)=8.1×10-9,Ksp(MnCO3)=1.8×10-11]
10.硫酸铜是一种应用极其广泛的化工原料。以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(g/100g水)见下表。
|
温度(℃) |
20 |
40 |
60 |
80 |
100 |
|
石膏 |
0.32 |
0.26 |
0.15 |
0.11 |
0.07 |
|
胆矾 |
32 |
44.6 |
61.8 |
83.8 |
114 |
请回答下列问题:
(1)红棕色滤渣的主要成分是 ;
(2)写出浸出过程中生成硫酸铜的化学方程式 ;
(3)操作I的操作温度应该控制在 ℃左右;
(4)从溶液中分离出硫酸铜晶体的操作II应为 、洗涤、干燥;
(5)反应产物中的NO可以循环使用,试仅用一个化学方程式表示NO转化为HNO3 : 。
9.铁单质及其化合物在生活、生产中应用广泛。请回答:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应是 。
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式
是 。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是 (用离子方程式表
示)。在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降除去,其原是
。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4 + 4 CO  3 Fe + 4 CO2 ,若
3 Fe + 4 CO2 ,若
有1.5 mol Fe3O4参加反应,转移电子的物质的量是 。
(5)下表中,对陈述I、II的正确性及其有无因果关系的判断都正确的是 (填字母)。
|
|
陈述I |
陈述II |
判断 |
|
A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
I对;II对;有 |
|
B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁得到铁 |
I对;II对;无 |
|
C |
铁属于过渡元素 |
铁和铁的某些化合物可用作催化剂 |
I错;II对;无 |
|
D |
在空气中铁表面形成致密氧化膜 |
铁不能与氧气反应 |
I对;II对;有 |
8.工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:



|


 对上述流程中的判断正确的是
对上述流程中的判断正确的是
 A.试剂X为稀硫酸
A.试剂X为稀硫酸
 B.反应 II 中生成Al(OH)3的反应为:CO2+AlO2-+2H2O==Al(OH)3↓+HCO3-
B.反应 II 中生成Al(OH)3的反应为:CO2+AlO2-+2H2O==Al(OH)3↓+HCO3-
 C.结合质子 ( H+) 的能力由强到弱的顺序是OH―>AlO2―>CO32-
C.结合质子 ( H+) 的能力由强到弱的顺序是OH―>AlO2―>CO32-
 D.Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
D.Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
7. 市场上有一种用于预防和治疗缺氧症状的便携式制氧器,利用过碳酸钠固体A(化学式为2Na2CO3·3H2O2)和灰黑色固体B(不溶于水)与水混合反应制得氧气。某同学对A、B两种物质进行探究,实验步骤及现象如下图所示。下列说法正确的是

A.B在反应①中可能起催化作用 B.设计③的目的是制取氧气
C.第②步分离混合物的方法是过滤 D.白色沉淀D为Ca(HCO3)2
6. 下列有关新技术的开发应用叙述正确的是
下列有关新技术的开发应用叙述正确的是
A.我国首创用CO2合成可降解的塑料聚二氧化碳,该塑料的结构简式为
B.有人建议用液氨作为清洁的汽车燃料,燃烧的最终的产物为氮气和水
C.“纳米泡沫”被称为第五形态的单质碳形似海绵并有磁性,与石墨化学性质完全不同
D.超临界CO2可从天然动植物中萃取、分离生物活性成分,它与一氧化碳互为同素异形体
5. 金属卤化物与卤素化合可生成多卤化物,如KI + I2 KI3,则有关KI3的叙述中,错误的是
金属卤化物与卤素化合可生成多卤化物,如KI + I2 KI3,则有关KI3的叙述中,错误的是
 A.I3-在溶液中存在平衡:I3- I2 + I- B.I2在KI溶液中溶解度增大是由于生成了I3-
A.I3-在溶液中存在平衡:I3- I2 + I- B.I2在KI溶液中溶解度增大是由于生成了I3-
C.KI3溶液遇淀粉不呈蓝色; D.将氯气通入KI3溶液中,I3-浓度减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com