
3. 电镀
原理:电镀是利用 原理在某些金属表面镀上一薄层其他金属或合金的过程,它是电解原理的又一重要应用。电镀可以使金属更加美观耐用,增强防锈抗腐能力。例如,钢铁是人们最常用的金属,但钢铁有个致命的缺点,就是它们易被腐蚀。防止钢铁发生腐蚀的一种最常用方法就是在其表面镀上其他金属,如锌、铜、铬、镍等。
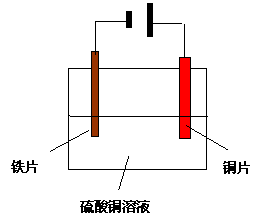 ①电极:
①电极:
阳极-- 金属或惰性电极
阴极-- 金属制品
②电镀液:含有 金属离子的电解质溶液。
溶液中CuSO4的浓度保持 或 4、电冶金
制取金属钠←电解熔融状态的氯化钠。
阳极: 阴极:
总反应:
冶炼铝
原理:
阳极: 阴极:
总式:
助熔剂:冰晶石(Na3AlF6 六氟合铝酸钠)
需要定期补充
[思考]工业上为什么用电解熔融氧化铝的方法冶炼铝而不用AlCl3?
[思考与交流]试比较电解饱和食盐水与电解熔融氯化钠的异同
(提示:比较电解质、电解装置、电极反应、电解产物)
|
|
电解饱和食盐水 |
电解熔融氯化钠 |
|
电解质 |
|
|
|
电解装置 |
|
|
|
电极反应 |
|
|
|
电解产物 |
|
|
[小结]
2.铜的电解精炼
一般火法冶炼得到的粗铜中含有多种杂质(如锌、铁、镍、银、金等),这种粗铜的导电性远不能满足电气工业的要求,如果用以制电线,就会大大降低电线的导电能力。因此必须利用电解的方法精炼粗铜。
粗铜 含杂质( 等)
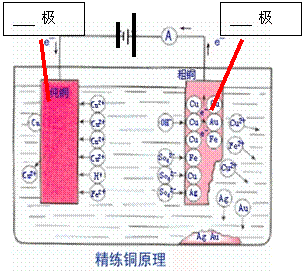
阳极:Zn
Fe
Ni
Cu
Ag
Au
阴极:
思考:电解完后,CuSO4溶液的浓度有何变化?
4、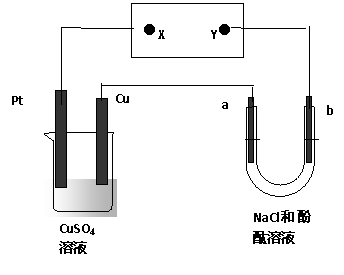 为下图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是
为下图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的pH值逐渐减小
D.CuSO4溶液的pH值不变
第二课时
[温习旧知]
|
装置 |
原电池 |
电解池 |
|
实例 |
|
|
|
原理 |
|
|
|
形成条件 |
|
|
|
电极名称 |
|
|
|
电子流向 |
|
|
|
电流流向 |
|
|
|
电极反应 |
|
|
|
能量转化 |
|
|
|
应用 |
|
|
[学习新知]
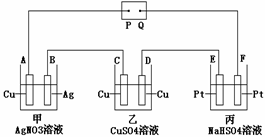
3、如右图所示用铂电极电解下表中各组物质的水溶液,电解一段时间以后,甲、乙两池中溶液的pH值均减小,而在①和④两极,电极产物的物质的量之比为1:2的是( )
甲 乙
A B C D
甲 KOH H2SO4 Na2SO4 CuSO4
乙 CuSO4 AgNO3 HCl HNO3
2、如上图乙所示,通电后A极上析出Ag,对该装置的有关叙述正确的是( )
A.P是电源的正极
B.F极上发生的反应为:4OH- - 4e-=2H2O+O2↑
C.电解时,甲、乙、丙三池中,除E、F两极外,其余电极均参加了反应
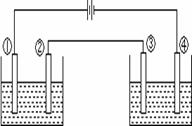 D.通电后,甲池的PH减小,而乙、丙两池溶液的PH不变
D.通电后,甲池的PH减小,而乙、丙两池溶液的PH不变
1、判断下图甲中A、B、C、D属于原电池的是 ,属于电解池的是 ;并写出下列装置的电极反应式。
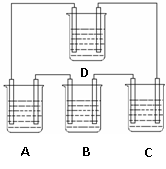
|
|
5、电极反应式、电解方程式的书写:
写出用石墨做电极电解CuSO4溶液的电极反应式及总的电解方程式,
①、首先分析、比较出阴阳极的放电离子:
CuSO4= 作 极:H+ Cu2+
H2O = 作 极:OH- SO42-
②、然后写电极反应式 :
阴极:
阳极:
③、最后使得失数相等,两极半反应相加得总方程式;
(电解离子方程式)
(电解化学方程式)
练习:完成下列溶液的电极反应。 (以石墨为电极电解)
硫酸溶液:
盐酸:
NaOH溶液:
CuBr2溶液:
KCl溶液:
CuSO4溶液:
Na2SO4溶液:
[自学指导二]根据上面的分析总结出用惰性电极电解电解质溶液的类型,并填入下表。
电解质溶液用惰性电极电解的示例
|
电解 类型 |
举 例 |
电极反应 |
溶液PH 变化 |
溶液复原方法 |
|
|
物质类别 |
实例 |
||||
|
仅溶剂 水电解 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|||
|
仅溶质 电解 |
|
|
|
|
|
|
|
|
|
|
|
|
|
溶质和 溶剂同 时电解 |
|
|
|
|
|
|
|
|
|
|
|
[巩固练习]
4.电解池电极反应规律(阳氧阴还)
(1)阴极: 电子, 反应
①电极本身不参加反应
②一定是电解质溶液中阳离子“争”得电子
(2)阳极: 电子, 反应
①若为金属(非惰性)电极,电极失电子
②若为惰性电极,电解质溶液中阴离子“争”失电子
(3)离子放电顺序
阴离子失去电子而阳离子得到电子的过程叫放电。
阳极:
①活性材料作电极时:金属在阳极失电子被氧化成阳离子进人溶液,阴离子不容易在电极上放电。
②用惰性电极(Pt、Au、石墨、钛等)时:溶液中阴离子的放电顺序(由难到易)是:
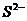 >
>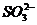 >
>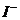 >
>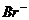 >
>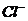 >
>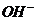 >
>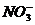 >
>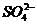 (等含氧酸根离子)>
(等含氧酸根离子)>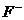
阴极:
无论是惰性电极还是活性电极都不参与电极反应,发生反应的是溶液中的阳离子。
阳离子在阴极上放电顺序是:
Ag+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>(H+)> Al3+>Mg2+>Na+>Ca+>K+
注:当离子浓度相差较大时,放电顺序要发生变化,相同时按H+,不同时按(H+)
[思考与交流] 若以铜为阳极,铁为阴极,电解氯化铜溶液,情况又如何?
[小结]
分析电解反应的一般思路:

3、构成电解池的条件:
①直流电源;

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com