
8.下列离子方程式不正确的是
A.碳酸氢钙溶液与少量氢氧化钠溶液反应Ca2++HCO3-+OH- CaCO3↓+H2O
CaCO3↓+H2O
B.用Cu和浓硫酸反应制SO2 Cu+4H++SO42- Cu2++SO2↑+2H2O
Cu2++SO2↑+2H2O
C.FeSO4溶液中加H2O2溶液Fe2++2H2O2+4H+=Fe3++4H2O
D.向含1molNH4Al(SO4)2溶液中逐滴加入4.5molNaOH溶液
2NH4++2Al3++9OH- 2NH3·H2O+Al(OH)3↓+AlO2-
2NH3·H2O+Al(OH)3↓+AlO2-
7.有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是
A.Y>Z>W>X B.Z>Y>W>X
C.W>Z>Y>X D.X>Y>Z>W
6.强酸和强碱在稀溶液里反应的热化学方程式可表示为:
H+(aq)+OH-(aq)=H2O(l); △H= -57.3 kJ·mol -1
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ;△H= -Q1 kJ·mol-1
HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ; △H= -Q2kJ·mol-1
上述均系在溶液中进行的反应,Q1、Q2的关系正确的是
A.Q1=Q2=57.3 B.Q1>Q2>57.3
C.Q1<Q2=57.3 D.无法确定
5.用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极 ②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③ C.②④ D.③④
4.以下现象与电化腐蚀无关的是
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎为纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌长期放置后在其奖牌的表面变暗
3.目前由乙烯合成乙醛的反应过程分三步进行:
①CH2=CH2+PdCl2+H2O=CH3CHO+2HCl+Pd ②Pd+2CuCl2=PdCl2+2CuCl
③2CuCl+1/2O2+2HCl=2CuCl2+H2O
下列叙述中正确的是
A.CH2=CH2是氧化剂 B.PdCl2是还原剂,O2是氧化剂
C.CuCl2、PdCl2都是催化剂 D.CuCl2是还原剂,O2是氧化剂
2.已知下列反应的热化学方程式为:⑴C(s)+O2(g)=CO2(g) ;ΔH 1=-393.5kJ/mol
⑵CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ;ΔH 2=-870.3kJ/mol
⑶H2(g)+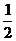 O2(g)=H2O(g) ;ΔH 3=-241.8kJ/mol
O2(g)=H2O(g) ;ΔH 3=-241.8kJ/mol
H2O(l) = H2O(g); ΔH 2=+44kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的ΔH 为
A.+488.3 kJ/mol B.-488.3 kJ/mol C.-244.15 kJ/mol D.+244.15 kJ/mol
1.用NA表示阿伏加德罗常数的值。下列叙述正确的组合是
① 2.3 g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0 .1NA
② 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
 ③ 标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA。
③ 标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA。
④ 32 g S8单质中含有的S-S键个数为2NA
⑤ 100 mL 1 mol·L-1 AlCl3溶液中含阳离子数大于0.1NA
⑥ 含有NA个NO2、N2O4分子的混合气体,降低温度,混合气体的分子总数小于NA
A.①②⑥ B.②④⑥ C.③⑤⑥ D.①⑤⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com