
19.Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.
(1)该电池的负极材料是________.电池工作时,电子流向________(填“正极”或“负极”).
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是___________________________________________________________________.欲除去Cu2+,最好选用下列试剂中的________(填代号).
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液.阴极的电极反应式是__________________________________________________________.若电解电路中通过2 mol电子,MnO2的理论产量为________g.
18.请回答氯碱的如下问题:(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k= (要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是 (填序号)
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
 ①图中X、Y分别是
、 (填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 ;
①图中X、Y分别是
、 (填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 ;
②分别写出燃料电池B中正极、负极上发生的电极反应正极: ; 负极: ;
③这样设计的主要节(电)能之处在于(写出2处) 、 。
17.(10分)KClO3和KIO3在日常生活、工农业生产和科研方面有着广泛的应用。
⑴ 实验室可用KClO3分解制取O2,KClO3受热分解的反应分两步进行:①4KClO3(s)=3KClO4(s)+KCl(s);②KClO4(s)=KCl(s)+2O2(g)。已知:
K(s) + 1/2 Cl2(g) = KCl(s) ΔH= -437kJ·mol-1
K(s) + 1/2 Cl2(g) + 3/2 O2(g) = KClO3(s) ΔH= -398kJ·mol-1
K(s) + 1/2 Cl2(g) + 2O2(g) = KClO4(s) ΔH = -433kJ·mol-1
则反应4KClO3(s)=3KClO4(s)+KCl(s)的ΔH=____________kJ/mol。
⑵ Ca(IO3)2是食品及饲料添加剂补充碘源的优良品种。工业上生产Ca(IO3)2的方法通常有两类:
方法一:氧化剂氧化法。如:用KClO3在盐酸存在条件下,将碘单质氧化为HIO3(KClO3被还原为Cl2),然后加Ca(OH)2中和制得Ca(IO3)2。
方法二:电化学氧化法。用适宜浓度的KOH溶液溶解工业精碘作为阳极液(3I2+6KOH = 5KI+KIO3 +3H2O),用稀KOH溶液为阴极液,电解氧化制 备KIO3,与CaCl2反应得到Ca(IO3)2。
①用KClO3氧化碘单质是一剧烈的放热反应,所以要控制加料速度,与电解氧化法相比缺点主要有 。
②电化学氧化法电解时的阳极反应式是 。
③某工厂用电化学氧化法制取Ca(IO3)2,每1kg碘单质理论上可生产纯度为97.8%Ca(IO3)2的质量为 kg(计算结果保留叁位有效数字)。
16.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
⑴已知:N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ/mol
尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H= 。
⑵某研究性学习小组在技术人员的指导下,按下列流程探究某种催化剂在不同空燃比(空气与燃油气的质量比)条件下对汽车尾气的催化效果。


①实验过程中除空燃比不同外,其他条件:汽车尾气的流速、 等必须相同。
②在一定条件下,测得尾气中的主要污染物的转化率与空燃比的关系如右图所示。空燃比约为 时,催化剂对汽车尾气的催化效果最好。
 ⑶CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。
⑶CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。
下列说法错误的是 。
A.负极的电极反应式为:CO+O2-―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
15.铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
 (2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应 负极反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤
。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ |
1.9 |
3.2 |
|
Fe2+ |
7.0 |
9.0 |
|
Cu2+ |
4.7 |
6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式
劣质不锈钢腐蚀的实验现象
14.右图是一种航天器能量储存系统原理示意图。
下列说法正确的是
 A. 该系统中只存在3种形式的能量转化
A. 该系统中只存在3种形式的能量转化
B. 装置Y中负极的电极反应式为:

C. 装置X能实现燃料电池的燃料和氧化剂再生
D. 装置X、Y形成的子系统能实现物质的零排放,
并能实现化学能与电能间的完全转化
第Ⅱ卷 (非选择题,共78分)
13.下图中,图1为甲烷和O2构成的燃料电池,图2为电解MgCl2溶液装置。用该装置进行实验,反应开始后,观察到x电极附近出现白色沉淀。下列说法正确的是
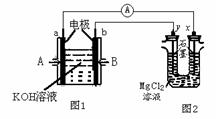 A.A处通入的气体为CH4,B处通入的气体为O2
A.A处通入的气体为CH4,B处通入的气体为O2
B.电池内部K+向b极移动,老虎OH-向a极移动
C.图1装置中发生的总反应为:
CH4+2O2===CO 2+3H2O
2+3H2O
D.图1、图2中电解质溶液的pH均增大





12.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为: C(石墨) + O2(g)=CO2(g);△H=-393.51kJ ·mol-1 C(金刚石) + O2(g)= CO2(g);△H=-395.41kJ ·mol-1 据此判断,下列说法中正确的是 A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低 B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高 C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低 D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
11.在同温同压下,下列各组热化学方程式中,△H2>△H 1的是
A.2H2(g)+O2(g)=2H2O(g), △H1;2H2(g)+O2(g)=2H2O(l), △H2
B.S(g)+O2(g)=SO2(g), △H1;S(s)+O2(g)=SO2(g), △H2
 C.C(s)+
C.C(s)+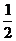 O2(g)=CO(g), △H1;C(s)+O2(g)=CO2(g), △H2
O2(g)=CO(g), △H1;C(s)+O2(g)=CO2(g), △H2
D.H2(g)+Cl2(g)=2HCl(g), △H1;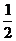 H2(g)+
H2(g)+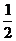 Cl2(g)=HCl(g),△H2
Cl2(g)=HCl(g),△H2
9.铅蓄电池的充放电反应为:Pb+PbO2+2H2SO4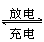
 PbSO4+2H2O,下列关于铅蓄电池的说法正确的是
PbSO4+2H2O,下列关于铅蓄电池的说法正确的是
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是 PbSO4(s)+2e-= Pb(s)+ SO42-(aq)
10 铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜。某研究性学习小组模拟工业法对铝片表面进行氧化处理。以铅片为阴极,铝片为阳极,以硫酸为电解液,用钼酸铵溶液处理阳极,以抑制电解生成的氧化铝被硫酸溶解。据此,下列说法正确的是
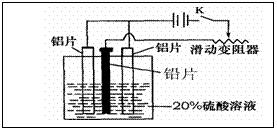
A.电解时电流从电源正极→导线→铝极→铅极→导线→电源负极
B. 在电解过程中,H+向阳极移动,SO42-向阴极移动。
C.电解过程中阳极周围的pH明显减小
D. 电解的总方程式可表示为:
2Al+6 H+  2Al3++3H2↑
2Al3++3H2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com