
12.为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催
化条件下,通过下列反应:CCl4+H2  CHCl3+HCl使CCl4转化为重要的化工原料氯仿
CHCl3+HCl使CCl4转化为重要的化工原料氯仿
(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为
77℃,CHCl3的沸点为61.2℃。
(1)在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)。
|
实验 序号 |
温度℃ |
初始CCl4浓度 (mol·L-1) |
初始H2浓度(mol·L-1) |
CCl4的平衡转化率 |
|
1 |
110 |
0.8 |
1.2 |
A |
|
2 |
110 |
1 |
1 |
50% |
|
3 |
100 |
1 |
1 |
B |
①此反应的化学平衡常数表达式为 ,在110℃时平衡常数为 。
②实验l中,CCl4的转化率A 50%(填“大于”、“小于”或“等于”)。
③实验2中,10 h后达到平衡,H2的平均反应速率为 。在此实验的平
衡体系中,再加入0.5 mol CCl4和1.0 mol HCl,平衡将向 方向移动。
④实验3中,B的值 (选填序号)。
A.等于50% B.大于50% C.小于50% D.从本题资料,无法判断
(2)120℃,在相同条件的密闭容器中,分别进行H2的初始浓度为2 mol·L一1和
4 mol·L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3,的百分含量(y%)随时间(t)的变化关系如下图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。

①在图中的四条线中,表示H2起始浓度为2mol·L一1实验的消耗CCl4的百分率变化曲线是 (选填序号)。
②根据上图曲线,氢气的起始浓度为 mol·L一1时,有利于提高CCl4的平衡转化率和产物中CHCl3的百分含量。你判断的依据是 。
11.PCl3与PCl5均是有机合成的重要中间体,两者存在以下相互转化关系:
PCl5(g)
 PCl3(g) + Cl2(g) △H=a kJ·mol-1 在210℃时,将4mol PCl5气体充入
PCl3(g) + Cl2(g) △H=a kJ·mol-1 在210℃时,将4mol PCl5气体充入
2L真空密闭容器中发生上述反应,得到如下数据:
|
时间(s) |
0 |
20 |
40 |
60 |
|
n(PCl5) |
4 |
2.8 |
2 |
2 |
(1)已知上述反应在温度较高时才能自发进行,则a 0(填﹥、﹦、﹤);
(2)计算从20s至40s共20s的时间内,用PCl3表示的平均反应速率为 。
210℃时该反应的平衡常数K= 。
(3)反应进行至60s后,将混合物的温度降低,重新达到平衡后氯气浓度将 (填“增大”、“减少”或“不变”)。
 (4)欲增大该反应的K值,可采取的措施有(填序号) 。
(4)欲增大该反应的K值,可采取的措施有(填序号) 。
A.降低温度 B.向混合气体中通入Cl2
C.使用高效催化剂 D.升高温度
(5)如右图是210℃时容器中PCl5物质的量的变化曲线,请在该图
中补画出该反应在160℃时PCl5物质的量的变化曲线。
10.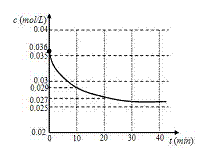 一氧化碳与水蒸气的反应为CO(g) + H2O(g)
一氧化碳与水蒸气的反应为CO(g) + H2O(g)  CO2(g) + H2(g)
在密闭容器中,将1.0 mol CO与1.0mol H2O混合
CO2(g) + H2(g)
在密闭容器中,将1.0 mol CO与1.0mol H2O混合
加热到434℃,在434℃的平衡常数K1 =9
(1)跟踪测定H2O的物质的量浓度,如图所示,
则0 -20 min ,H2O的反应速率是
(2)请在图中用实线绘制出在该温度下加入正催化剂后,H2O的物质的量浓度变化图线。
(3)从434℃升温至800℃,800℃的平衡常数K2 =1,则正反应为_____________(填“放 热反应”或“吸热反应”或“不能确定”)。 (4)求在800℃反应达平衡时,CO转化为CO2的转化率(写出必要的计算过程)
9.控制、治理氮氧化物对大气的污染是改善大气质量的重要方面。
 (1)火力发电厂的燃煤排烟中含大麓的氮氧化物(NOx),可利用甲烷和NOx在一定条件下反应消除其污染,则CH4与NO2反应的化学方程式为 。
(1)火力发电厂的燃煤排烟中含大麓的氮氧化物(NOx),可利用甲烷和NOx在一定条件下反应消除其污染,则CH4与NO2反应的化学方程式为 。

 (2)在一密闭容器中发生反应2NO2
(2)在一密闭容器中发生反应2NO2 2NO+O2,反应过程中NO2的浓度随时间变化的情况如右下图所示。请回答:
2NO+O2,反应过程中NO2的浓度随时间变化的情况如右下图所示。请回答:
 ① 依曲线A,反应在前3 min内氧气的平均反应速率为
。
① 依曲线A,反应在前3 min内氧气的平均反应速率为
。
 ② 若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则此条件是
② 若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则此条件是
 (填“浓度”、“压强”、“温度”或“催化剂”)。
(填“浓度”、“压强”、“温度”或“催化剂”)。
 ③ 曲线A、B分剐对应的反应平衡常数的大小关系是
③ 曲线A、B分剐对应的反应平衡常数的大小关系是
 。(填“>”、“<”或“=”)
。(填“>”、“<”或“=”)
(3)一定温度下,容密闭容器中N2O5可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g) Ⅰ 2NO2(g)
4NO2(g)+O2(g) Ⅰ 2NO2(g) 2NO(g)+O2(g) Ⅱ
2NO(g)+O2(g) Ⅱ
则反应Ⅰ的平衡常数表达式为
。若达平衡时,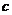 (NO2)=0.4 mol·L
(NO2)=0.4 mol·L ,
,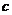 (O2)=1.3 mol·L
(O2)=1.3 mol·L ,则反应Ⅱ中NO2的转化率为
,N2O5(g)的起始浓度应不低于
mo1·L
,则反应Ⅱ中NO2的转化率为
,N2O5(g)的起始浓度应不低于
mo1·L 。
。
8.CO与H2在催化剂作用下合成甲醇的反应为:CO(g)+ 2H2(g)
2H2(g)  CH3OH(g)。在容积均
CH3OH(g)。在容积均
为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控
温。实验测得相关数据如下图1和图2。
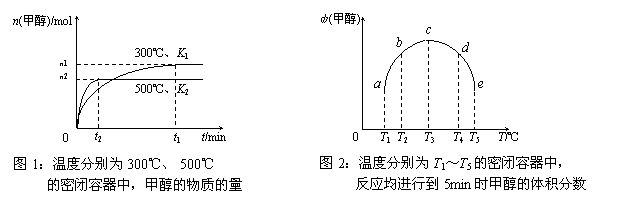
下列有关说法错误的是
A.该反应的正反应是气体体积减小的放热反应
B.K1<K2 (K为该条件下反应的平衡常数)
C.反应进行到5min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动
D.将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或减压
7.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)  2C(g),
2C(g),
达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下
 图所示。下列说法中正确的
图所示。下列说法中正确的
A.30min时降低温度,40min时升高温度
B.8min前A的平均反应速率为0.08mol/(L·min)
C.反应方程式中的x=1,正反应为吸热反应
D.20min-40min间该反应的平衡常数均为4
6.对于平衡体系:aA(g)+bB(g) cC(g)+dD(s) △H<0,下列判断中正确的是
cC(g)+dD(s) △H<0,下列判断中正确的是
A.若(a+b)<(c+d),则反应一定能自发向右进行。
B.若从正反应开始,起始时A、B的物质的量之比为a :b,则平衡时A、B的转化率之比也为a :b
C.若a+b=c+d,在平衡体系中共有气体m mol,再向其中充入n mol B,则达到平衡时气体总物质的量等于(m+n)mol。
D.若a+b=c ,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com