
26、标准状况下1体积水中溶解了448体积的NH3气体,得到密度为0.9g/cm3的氨水,求溶液的质量分数和物质的量浓度。(保留一位小数)
25、(10分)已知热稳定性CuSO4·5H2O<CuSO4<CuO<Cu2O,取25gCuSO4·5H2O晶体,加热使之均匀、缓慢升温到1000℃并恒温1小时,试通过计算回答下列问题(如果是混合物,要计算混合物各组分的质量):
⑴在某中间温度时,固体产物的质量 ( 有、无)可能10g,其组成是
(若无,此空不需填写)
⑵不考虑实验带来的误差,此反应条件下,最终固体产物为 克,若气态产物除去水后,气体的物质的量准确的范围是_____________________________
⑶如果某同学此实验时最后固体质量为7.6g,其组成是 。
24、(17分)已知A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增。A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,F在本周期元素中原子半径最小。则: 
(1)A、B、C、D、E、F的名称分别是 。
(2)在A至F中任选元素,写出二种含极性键的非极性分子的结构式
,写出一种含非极性键的离子化合物的电子式
。
(3)由B和D组成,且B和D的质量比为3∶8的化合物的电子式是 , 
该物质与E的同周期相邻主族元素的单质反应的化学方程式为

(4)F单质与E的最高价氧化物的水化物反应的化学方程式为
。
(5)将8g
BA4完全燃烧后恢复到室温,放出热量a kJ,写出表示BA4的燃烧热的热化学方程式 
23、(10分)实验室配制一定物质的量浓度的烧碱溶液,在下列各种情况下,所得溶液的物质的量浓度将如何变化(填“偏高”、“偏低”或“无影响”)
⑴在天平两托盘上分别垫上纸质、大小相同的两片纸,再将氢氧化钠固体放在纸上称量__________。
⑵定容时,俯视观察刻度线__________。
⑶在倒入氢氧化钠溶液前,容量瓶中有少量水,未经干燥___________。
⑷在容量瓶中加水至刻度线后,振荡,发现液体凹面低于刻度线,再用胶头滴管加蒸馏水至刻度线___________。
⑸将配制好的溶液转移至刚洗净的试剂瓶____________。
22、根据相关的化学原理,下列判断正确的是( )
A、由于水中存在氢键,所以稳定性:H2O>H2S
B、由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2 C、若A2
+ 2D- == 2A- +
D2,则氧化性D2>A2
D、若R2-和M+的电子层结构相同,则离子半径R2->M+



21、下列有关比较中,错误的是( ) 
A、 热稳定性:NH3>PH3>H2S 
B、 熔点:石英>食盐>冰 
C、 酸性:醋酸>碳酸>苯酚 
D、 分散质粒子的直径: Fe(OH) 3悬浊液>Fe(OH) 3胶体>FeCl3溶液 
20、人们在研究金星大气成分时发现金星大气中有一种称为硫化羰(COS)的分子,其结构与CO2类似,硫化羰是一种与生命密切相关的物质,下列有关COS的推测不正确的是( )
A、COS分子是含有极性键的极性分子
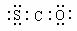 B、COS的电子式为:
B、COS的电子式为:
C、COS的分子中所有原子满足8电子稳定结构
D、硫化羰分子中三个原子处于同一直线上
19、设NA表示阿伏加德罗常数,下列叙述中正确的是( ) A、1molSiO2晶体内含有2NA个Si-O键
B、在0.1mol熔融KHSO4中,含有0.1NA个SO42-
C、在0.5L 1mol·L-1的盐酸中所含粒子总数为NA
D、46g四氧化二氮和二氧化氮的混合气体中含有原子数为3NA 
18、下列关于胶体的叙述不正确的是 ( )
A、布朗运动是胶体微粒特有的运动方式,可以据此把胶体和溶液、悬浊液区别开来
B、光线透过胶体时,胶体发生丁达尔现象
C、用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
D、胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象

17、将钠、镁、铝各0.2mol 分别放入100 mL 1 mol/L的盐酸中,同温同压下产生的气体体积比是( )
A、1∶2:3 B、6∶3∶2 C、2∶1∶1 D、1∶1∶1 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com