
28、(7分)已知1 molCO气体完全燃烧生成CO2 气体放出283 kJ热量;1 mol氢气完全燃烧生成液态水放出286 kJ热量;1 molCH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1)写出氢气燃烧的热化学方程式 。
(2)若1 molCH4气体完全燃烧生成CO2气体和水蒸气,放出热量为 890 kJ( 填“>”、 “<”、“= ”)。
(3)若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水时,则放出热量(Q)的取值范围是 。
(4)若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水,且CO2和水的物质的量相等时,则放出热量(Q)的的取值范围是_____________
_____________________________________________________________________。
27、(11分)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:_______________________________________________________。
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3•x H2O),反应的化学方程式为:_______________________________________________________________。
(3)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式_____________________________。
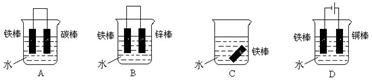
(4)下列哪个装置可防止铁棒被腐蚀_____________ 。
(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:
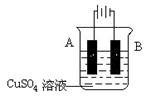
请回答:
① A电极对应的金属是_____(写元素名称),B电极的电极反应式是 。
② 若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为__________mol。
③ 镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
26、某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1 盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?
(填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
|
实 验 用 品 |
溶 液 温 度 |
中和热 △ |
|||
|
t1 |
t2 |
||||
|
① |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.3℃ |
|
|
② |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.5℃ |
已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响。
25.爱迪生电池在充电和放电时发生的反应:
Fe+ NiO2+2H2O Fe(OH)2+Ni(OH)2,下列该蓄电池推断错误的是(
)
Fe(OH)2+Ni(OH)2,下列该蓄电池推断错误的是(
)
① 放电时,Fe参与负极反应,NiO2参与正极反应 ② 充电时,阴极上的电极反应式为:Fe(OH)2 + 2e- = Fe + 2OH- ③ 放电时,电解质溶液中的阴离子向正极方向移动 ④ 放电时,负极上的电极反应式为:Fe + 2H2O- 2e- = Fe(OH)2 + 2H+ ⑤ 蓄电池的电极必须浸入某种碱性电解质溶液中
A、只有③ B、③④ C、④⑤ D、①②⑤
第Ⅱ卷(非选择题 共72分)
24.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的:( )
A、NaOH固体 B、K2CO3溶液 C、CuSO4固体 D、CH3COONa固体
23.反应:NO+CO2 N02+CO在密闭容器中进行,下列哪些条件加快该反应速率:(
)
N02+CO在密闭容器中进行,下列哪些条件加快该反应速率:(
)
A、扩大体积使压强减小 B、体积不变充入CO2使压强增大
C、体积不变充入He气使压强增大 D、压强不变充入N2使体积增大
22、下列有关热化学方程式的叙述正确的是:( )
A、已知2H2(g)+O2(g) = 2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ
B、已知4P(红磷,s)= P4(白磷,s);△H>0,则白磷比红磷稳定
C、含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+1/2H2SO4(aq)= 1/2Na2SO4(aq)+H2O(l);△H=-57.4kJ/mol
D、己知C(s)+ O2(g)= CO2(g);△H1C(s)+1/2 O2(g)= CO(g);△H2 则△H1>△H2
21、化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A、电解饱和食盐水时,阳极的电极反应式为:2Cl- - 2e- = Cl2 ↑
B、氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- = 4OH-
C、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e- = Cu2+
D、钢铁发生电化腐蚀的正极反应式:Fe-2e- = Fe2+
20.一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷和氧气,其电极反应式为:C2H6+18OH--14e- =2CO32-+12H2O,7H2O+7/2O2+14e- =14OH-,有关此电池的推断正确的是:( )
A、电解质溶液中电子向正极移动
B、放电一段时间后,KOH的物质的量浓度不变
C、通乙烷的电极为负极
D、参加反应的O2和C2H6的物质的量之比为2:7
19.下列说法正确的是( )
A、凡是放热反应都是自发的,由于吸热反应都是非自发的
B、自发反应一定是熵增大,非自发反应一定是熵减少或不变
C、电解池的反应属于自发过程
D、自发反应在恰当条件下才能实现
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com