
7、下列有关胶体和溶液的比较中正确的是
A、溶液澄清透明,胶体浑浊不透明
B、溶液呈电中性,胶体带有电荷
C、光束通过溶液没有特殊现象,光束通过胶体有丁达尔效应
D、溶液中溶质粒子的运动有规律,胶体粒子的运动无规律
6、9.2g金属钠投入到足量的重水中,则产生的气体中含有
 A、0.2mol中子 B、0.4mol电子
A、0.2mol中子 B、0.4mol电子  C、0.2mol质子 D、0.4mol分子
C、0.2mol质子 D、0.4mol分子
5、下列说法错误的是
A、乙醇和乙酸都是常用调味品的主要成分
B、乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高
C、乙醇和乙酸都能发生氧化反应
D、乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应
4、等物质的量的下列化合物在相应条件下完全分解后得到氧气最多的是
A、KClO3(加MnO2催化剂,加热) B、KMnO4加热
C、H2O2(水溶液,加MnO2催化剂) D、HgO(加热)
3、请你运用所学的化学知识判断下列有关化学观念的叙述中错误的是
A、几千万年前地球上某条恐龙体内的某种原子可能在你的身体里
B、用斧头将木块一劈为二,在这个过程中个别分子恰好分成原子
C、一定条件下,石墨可以变成金刚石
D、一定条件下,水能在2℃时结冰
2、某同学欲配制含有大量下列各离子的溶液,其中能实现的是
A、K+、H+、SO42-、OH- B、Na+、Ca2+、CO32-、NO3-
C、Na+、H+、Cl-、CO32- D、Na+、Cu2+、Cl-、SO42-
1、下列操作过程中一定有氧化还原反应发生的是

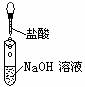
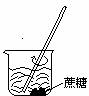
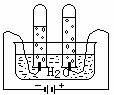
A B C D
2.附加隐含条件的应用规律
⑴溶液无色透明时,则溶液肯定无有色离子。如Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+(浅绿色)、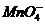 (紫红色)等都有颜色,若无色溶液则说明这些离子不存在。
(紫红色)等都有颜色,若无色溶液则说明这些离子不存在。
⑵强碱性溶液中肯定不存在与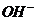 起反应的离子。
起反应的离子。
⑶强酸性溶液中肯定不存在与H+起反应的离子
⑷与水反应的离子,如O2-、N3-、P3-等在水溶液中不存在。
试题枚举
[例1]下列离子方程式正确的是
A.NaHSO3溶液与NaOH溶液反应:HSO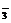 +OH-=SO
+OH-=SO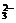 +H2O
+H2O
B.少量二氧化碳通入足量的NaOH溶液:CO2+OH-=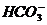
C.Fe与盐酸反应产生H2:2Fe+6H+=2Fe3++3H2↑
D.氨水和醋酸溶液混合NH3·H2O+CH3COOH=NH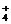 +CH3COO-+H2O
+CH3COO-+H2O
解析: 判断离子方程式的正误应注意①是否符合客观实际;②应该用化学式表示的(气体、沉淀、水、弱酸、弱碱、氧化物、单质等)是否写对,应该删掉的离子是否删去;③是否配平,电子转移是否合理.
据此检查各选项,A、D正确.B错,因少量的CO2通入足量的NaOH溶液中,应生成CO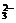 .
.
正确的写法为:CO2+2OH-=CO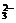 +H2O
+H2O
C错.因不符合客观实际,应生成Fe2+.
正确的写法为:Fe+2H+=Fe2++H2↑
答案: AD
[例2.]下列各组离子中,能在强酸溶液里大量共存,并且溶液呈无色透明的是
A.MnO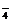 ,K+,Na+,SO
,K+,Na+,SO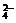 B.Na+,K+,HCO
B.Na+,K+,HCO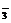 ,Cl-
,Cl-
C.Mg2+,NH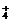 ,Cl-,NO
,Cl-,NO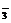 D.Ba2+,K+,S2-,SO
D.Ba2+,K+,S2-,SO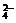
解析:对于离子能否共存问题:必须考虑两个问题,一看同组离子是否发生反应(复分解或氧化还原),二看是否满足题干要求.
有颜色离子:Fe3+,Fe2+,Cu2+,MnO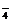 ……
……
强酸性(或强碱性),说明溶液中除离子组内各离子外,还应有H+或(OH-),典型的氧化性离子(如Fe3+,MnO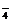 ,Cr2O
,Cr2O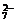 等)和典型的还原性离子(如Fe2+,S2-,I-,SO
等)和典型的还原性离子(如Fe2+,S2-,I-,SO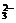 等)在溶液中会发生氧化还原反应.据以上分析得此题正确选项为C.
等)在溶液中会发生氧化还原反应.据以上分析得此题正确选项为C.
答案:C
[例3](1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液中至中性,请写出发生反应的离子方程式: 。
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式 。
解析:题目要求NaHSO4溶液与Ba(OH)2溶液反应呈中性,也即要求写出的离子方程式属于下列反应 2NaHSO4 + Ba(OH)2 = 2H2O + Na2SO4 + BaSO4↓。则离子方程式为:2H+ + SO42- + Ba2+ + 2OH- = BaSO4 ↓ + 2H2O 。若向上述溶液中继续滴加B(OH)2,则有 Ba2+ + SO42- = BaSO4 ↓
答案:2H+ + SO42- + Ba2+ + 2OH- = BaSO4 ↓ + 2H2O
Ba2+ + SO42- = BaSO4 ↓
1.同一溶液中若离子间符合下列任意一个条件就会发生离子反应,离子便不能在同一溶液中大量共存.
(1) 生成难溶物或微溶物:如Ba2+与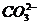 、Ag+与Br-、Ca2+与
、Ag+与Br-、Ca2+与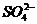 等不能大量共存。
等不能大量共存。
(2)生成气体或挥发性物质:如NH4+与OH-、H+与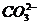 、
、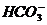 、S2-、
、S2-、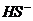 、
、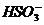 、
、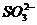 等不能大量共存。
等不能大量共存。
(3) 生成难电离的物质:如H+与CH3COO-、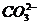 、S2-、
、S2-、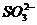 等生成弱酸;OH-与NH4+、Cu2+、Fe3+等生成弱碱或沉淀;H+与OH-生成水,这些离子不能大量共存。
等生成弱酸;OH-与NH4+、Cu2+、Fe3+等生成弱碱或沉淀;H+与OH-生成水,这些离子不能大量共存。
(4) 发生氧化还原反应:氧化性离子(如Fe3+、NO3-、ClO-、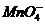 等)与还原性离子(如S2-、I-、Fe2+、
等)与还原性离子(如S2-、I-、Fe2+、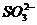 等)因在溶液中(特别是在酸性溶液中)发生氧化还原反应而不能大量共存。
等)因在溶液中(特别是在酸性溶液中)发生氧化还原反应而不能大量共存。
(5)形成配合物:如Fe3+与SCN-反应生成配合物而不能大量共存。
3.检查离子方程式书写是否正确的几个原则
⑴必须满足三个守恒原则
①元素守恒:反应前后各元素的原子个数相等。
②电荷守恒:方程式左右两边离子的电荷总数相等。
③电子守恒(价守恒):对于氧化还原反应,反应过程中元素化合价升高总数与降低总数相等。
(2)正确把握与“量”有关的反应原则
①某物质若其阴、阳离子都参加了反应,且都反应完全,则方程式中,该物质阴、阳离子个数比应与化学式中组成一致,如Ba(OH)2与H2SO4溶液反应,离子方程式为:
Ba2++2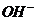 +2H++
+2H++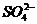 ═BaSO4↓+2H2O
═BaSO4↓+2H2O
注意:在H+、OH-、H2O之前的化学计量数2是不可能省去。
②若反应物之间由于量比不同可发生反应时,必须结合量比书写。如Ca(OH)2与NaHCO3反应,有两种情况:
若Ca(OH)2过量:Ca2++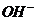 +
+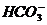 ═CaCO3↓+H2O
═CaCO3↓+H2O
若NaHCO3过量:Ca2++2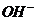 +2
+2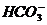 ═CaCO3↓+2H2O+
═CaCO3↓+2H2O+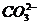
(3)注意反应条件的原则
①溶液酸碱性条件:有些物质在不同条件下存在形态不同,如反应产物有碳酸盐时,则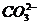 与
与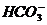 取决于溶液碱性强弱,强碱溶液中写
取决于溶液碱性强弱,强碱溶液中写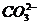 ,弱碱溶液中(如CO2过量时)写
,弱碱溶液中(如CO2过量时)写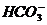 。
。
②温度条件:NH4Cl与NaOH溶液反应时,只有在浓溶液且加热条件下,才可写成NH3↑,否则写成NH3·H2O。
③浓度条件:如BaCl2溶液与稀的NaHCO3溶液不发生反应,而BaCl2溶液与浓的NaHCO3反应,生成BaCO3↓,其离子方程式为:
Ba2++2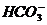 ═BaCO3↓+H2O+CO2↑
═BaCO3↓+H2O+CO2↑
④注意实验操作条件:如Na2CO3溶液与稀盐酸之间的反应,若将少量的HCl往多量Na2CO3溶液中滴加时:先发生: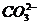 +H+═
+H+═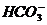 后发生:H++
后发生:H++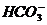 ═CO2↑+H2O;若将少量Na2CO3往多量HCl中滴加时:
═CO2↑+H2O;若将少量Na2CO3往多量HCl中滴加时: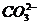 +2H+═CO2↑+H2O。
+2H+═CO2↑+H2O。
(4)必须遵循依据客观实验事实的原则
只有电解质参加的且具备电离条件的反应,才可写出离子方程式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com