
1.集合A=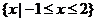 ,B=
,B=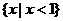 ,则
,则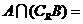 ( )
( )
 A.
A.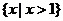 B.
B.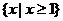
C.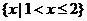 D.
D.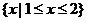
22.(15分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
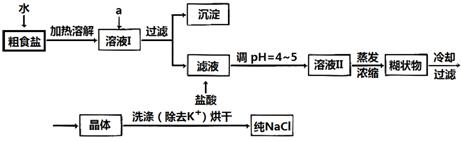
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液
Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为_______ __(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_____ ____。
 (2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,
(2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,
所用仪器除天平、药匙、玻璃棒外还有___ _____
(填仪器名称)。
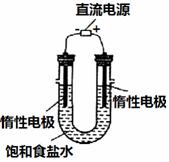
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,
则同样条件下收集的Cl2_____(填“>”、“=”或“<”)2 L,
原因是_________。装置改进后,可用于制备NaOH溶液,
若测定溶液中NaOH的浓度,常用的方法是__________。
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4 ZnSO4+H2↑;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
可选用制备气体的装置:
21.(11分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化的主要化学反应方程式为:_______________________。
(2)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)+ CO(g)CH3OH(g);ΔH=-90.8 kJ·mol-1
② 2CH3OH(g)CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g)+H2O(g)CO2(g)+ H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g)+ 3CO(g)CH3OCH3(g)+CO2 (g)的ΔH=___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)CH3OCH3(g)+H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小: v正______ v逆 (填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) =_________;该时间内反应速率v(CH3OH) =__________。
20.(12分)有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到B(C4H4O4)和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有 (选填序号)。
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应
(2)B分子所含官能团的名称是 。
(3)B分子中没有支链,其结构简式是 ,B的具有相同官能团的同分异构体的结构简式是 。
(4)由B制取A的化学方程式是 。
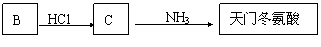 (5)天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取:
(5)天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取:
天门冬氨酸的结构简式是 。
19.(8分)化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为 。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,单质Y的电子式为 ;Z分子的空间结构呈 。 ②A的化学式是
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是
18.由氧化铜和氧化铁的混合物a g,加入2 mol·L-1的硫酸溶液50 mL,恰好完全溶解,若将a g的该混合物在过量的CO气流中加热充分反应,冷却后剩余固体的质量为 ( )
A.1.6a g B.(a –1.6) g C.(a –3.2) g D.无法计算
17.X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于 ( )
A.33% B.40% C.50% D.65%
16.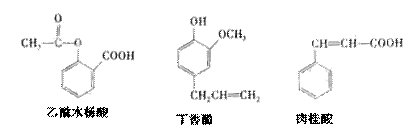 可用于鉴别以下三种化合物的一组试剂是 ( )
可用于鉴别以下三种化合物的一组试剂是 ( )
①银氨溶液 ②溴的四氯化碳溶液
③氯化铁溶液 ④氢氧化钠溶液
A.②与③ B.③与④ C.①与④ D.①与②
15.下列实验操作中,先后顺序正确的是 ( )
A.稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水
B.为测定硫酸铜晶体的结晶水含量,称样时,先称取一定量的晶体,再放入坩埚中
C.在制取干燥纯净的氯气时,先使氯气通过水(或饱和食盐水),后通过浓硫酸
D.为检验酸性溶液中的Cl-和SO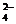 ,先加硝酸银溶液,滤去沉淀后滤液中加硝酸钡溶
,先加硝酸银溶液,滤去沉淀后滤液中加硝酸钡溶
液
14.将足量稀盐酸加到下列固体混合物中,只能发生一种反应的是 ( )
A.Mg、AlCl3、NaAlO2 B.KNO3、NaCl、CH3COONa
C.NaClO、Na2SO3、BaCl2 D.Ba(NO3)2、FeSO4、NH4HCO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com