
24.(11分)信息I:通常人们拆开1mol某化学键所吸收的
能量看成该化学键的键能,键能大小可以平衡量化学键
的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
信息II;SiX4为分子式。
|
化学键 |
Si-O |
Si-F |
H-H |
H-Cl |
Si-Si |
Si-C |
Si-Cl |
|
键能 /kJ·mol |
460 |
525 |
436 |
431 |
176 |
347 |
360 |
请完成下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
 SiC Si; SiF4 SiO2 SiF4 SiCl4
SiC Si; SiF4 SiO2 SiF4 SiCl4
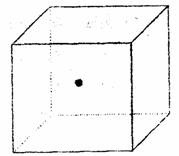
(2)右图立体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的
硅原子。
(3)工业上的高纯硅可通过下列反应制取:
|
SiCl4(g)+2H2(g)====Si(S)+4HCl(g)
该反应的反应热:△H= kJ/mol
(4)理论推测第二主族元素的氯化物如果几何形状
相同时熔点由高到低的顺序为
BeCl2>MgCl2>CaCl2>SeCl2>BaCl2,原因是 ,实际测定的结果BeCl2的熔点最低,其它氯化物熔点高低顺序不变理由是
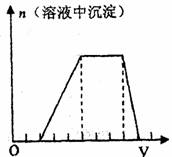
23.(7分)某溶液可能含有H+、Na+、NH+4、Mg2+、Fe3+、
Al3+、SO2-4等离子,当向该溶液中加入某浓度的NaOH
溶液时,发现生成沉淀的物质的量随NaOH溶液体积变
化如图所示,由此可知,该溶液中肯定含有的阳离子是
;且各离子的物质量之比为
;肯定不含的阳离子是 。
22.(6分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。当它们混
合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸敢,放出256.652kJ的热量。
(1)该反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g);ΔH=44 kJ·mol-1,则16g液态肼与液态过氧化氢反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点
 。
。
21.(9分)X、Y、Z三种元素,X与氢气能形成气态XH4,其中X的质量分数为75%,且X与Y能形成XY2型化合物。Y的核内质子数和中子数相等,在Y的氢化物中,Y的质量分数为88.9%,Z的最高价氧化物的水化物是酸性最强的酸。
(1)X元素所形成的同素异形体中硬度最大的是 (填名称),它属于 晶体。
(2)Y的氢化物属于 晶体,它的电子式是 。
(3)Z元素位于周期表第 周期第 族,它的氢化物是 (填“极性”或“非极性”)分子。
(4)X与Z形成的化合物其分子的空间构型是 ,它的晶体属于 晶体。
20. 已知72K时,2SO2(g)+O2(g) 2SO3(g);△H=-197kJ/mol。在相同温度下向密闭容器中通入1molSO2和0.5molO2达到平衡时放出热量Q1,在相同温度下,向同样容积的密闭容器中通入2molSO2、1molO2,达到平衡时放出热量Q2,则下列关系正确的是 ( )
已知72K时,2SO2(g)+O2(g) 2SO3(g);△H=-197kJ/mol。在相同温度下向密闭容器中通入1molSO2和0.5molO2达到平衡时放出热量Q1,在相同温度下,向同样容积的密闭容器中通入2molSO2、1molO2,达到平衡时放出热量Q2,则下列关系正确的是 ( )
A.2Q1=Q2 B.2Q1>Q2 C.Q1<Q2<197kJ D.Q1=Q2<197kJ
第Ⅱ卷(主观题,共60分)
19.下列说法正确的是(NA为阿伏加罗常数) ( )
A.124g白磷含有P-P键的个数为4NA
B.12g金刚石中含C-C键的个数为1.5NA
C.12g石墨中含有六元环的个数为NA
D.60gSiO2中含有Si-O键的个数为4NA
18.下列各组离子在指定溶液中能大量共存的是 ( )
①无色溶液中K+、Na+、MnO-4、SO2-4
②pH=1的溶液中CO2-3、Na+、AlO-2、NO-3
③加入Al能放出H2的溶液中Cl-、HCO-3、SO2-4、NH+4
④由水电离的C(OH)-=10-13mol/L的溶液中,Na+、Ba2+、Cl-、Br-
⑤有较多的Fe3+的溶液中,Na+、NH+4、SCN-、HCO-3
⑥酸性溶液中Fe3+、Al3+、NO-3、I-、Cl-
A.①② B.③⑥ C.②④ D.③⑤
17.Cu2S与一定浓度的HNO3反应生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1:1时,实际上参加反应的Cu2S与HNO3的物质的量之比为
( )
A.1:7 B.1:9 C.1:5 D.2:9
16.超氧化钾(KO2)的晶体结构与NaCl相似,下列对
KO2晶体结构的描述中正确的是 ( )
A.和阳离子距离相同且最近的阴离子共有8个
B.和阳离子距离相同且最近的阴离子共有6个
C.KO2的晶体中阴、阳离子个数比为1:1
D.与阳离子相邻的阴离子形成的几何形状为正四面体
15.如图所示,图中每条折线表示周期表IA-VIIA族中
的某一族元素氢化物沸点变化,每个小黑点代表一种
氢化物,其中a点代表的是 ( )
A.H2S B.HCl
C.PH3 D.SiH4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com