
1、成键电子对数:4 (1分)未成键电子对数:8 (1分)
5. 加Na2S2O3 (1分)
2Ca(OCl)2 + Na2S2O3 + H2O = 2CaCl2 + Na2SO4 + H2SO4 (1分)
4. 3Ca(ClO)2=Ca(ClO3)2 + 2CaCl2 (1分)
ClO-的歧化速率与温度有关,温度愈高,歧化越快,温度高漂白液分解,氯耗增加,所以温度不能高。(1分)
3. 因为亚硫酸盐浆液以亚硫酸和酸性亚硫酸盐的混合液为蒸煮剂,在蒸煮过程中会产生SO2,与有机色素结合为无色化合物。(2分)
2.将加热过的产物溶于水,检验溶液中是否含有SO4 2-、S2-
SO42-离子的检出:SO42-+Ba2+=BaSO4 ↓ 不溶于盐酸。(1分)
S2-离子的检出:(1分)
方法1: 加沉淀剂:S2-+ Pb2+=PbS↓ (黑) 其他特征沉淀剂也可得分。
方法2: 醋酸铅试纸变黑
方法3:加盐酸S2-+2H+=H2S↓(可闻到硫化氢特殊气味)
1.4Na2SO3=3Na2SO4+Na2S,由于Na2S的碱性较强。(2分)
3.设:碳酸真实的第一步解离常数为Ka1′
Ka1= [H+][HCO3-] / [ H2CO3+ CO2] = 4.45×10-7(2分)据题意: [ CO2] / [H2CO3] = 601
真实的Ka1′= [H+][HCO3-] / [ H2CO3] = 602 ×4.45×10-7= 2.68×10-4 (2分)
2.两个∏34(1分)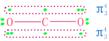
(1分)
1.石灰岩的形成是CaCO3的沉积结果,海水中溶解一定量的CO2,因此CaCO3与CO2,H2O之间存在着下列平衡:
CaCO3(s) + CO2(g)
+ H2O Ca(HCO3)3(aq)
(1分)
Ca(HCO3)3(aq)
(1分)
海水中CO2的溶解度随温度的升高而减小,随压力的增大而增大,在浅海地区,海水底层压力较小,同时水温比较高,因而CO2的浓度较小,根据平衡移动的原理,上述平衡向生成CaCO3方向移动,因而在浅海地区有较多的CaCO3沉淀。(2分)
深海地区情况恰相反,故深海底层沉积的CaCO3很少。(1分)
2.在催化剂的作用下反应方程式为: (2分)
SrCO3 + 2NH4Cl = SrCl2 + (NH4 ) 2CO3
SrCl2 + 2NH4HCO3 = SrCO3 ↓ + 2NH4Cl + CO2 ↑ +H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com