
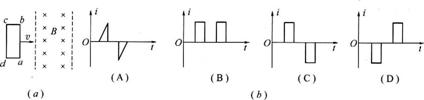
2.如下图(a)所示,一个由导体制成的矩形线圈,以恒定速度v运动,从无场区域进入匀强磁场区域,然后出来.若取逆时针方向为电流的正方向,那么在(b)图中所示的图像中,能正确反映出回路中感应电流随时间变化的是图( )
1.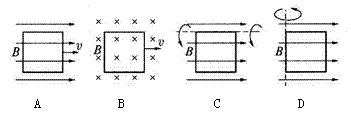 如图所示,有一正方形闭合线圈,在足够大的匀强磁场中运动.下列四个图中能产生感应电流的是图
( )
如图所示,有一正方形闭合线圈,在足够大的匀强磁场中运动.下列四个图中能产生感应电流的是图
( )
34.(10分)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl:用水溶解,滤去残渣,滤液酸化后,K2MnO4转化为MnO2和KMnO4;滤去MnO2(此物质不循环使用)沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。请回答:
(1)软锰矿制备K2MnO4的化学方程式是 。
(2)K2MnO4制备KMnO4的离子方程式是 。
(3)若用8.7g软锰矿(含MnO230%)进行上述实验,计算KMnO4的理论产量n(KMnO4)= 。
(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2该反应的化学方程式是
。
(5)上述制得的KMnO4产品63.2g,恰好与0.5mol Na2C2O4反应完全,计算该KMnO4的
纯度为 。
2009-2010年度哈师大附中高三上学期第一次月考
33.(10分)根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
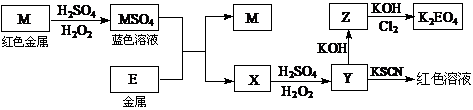
⑴写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
⑵某同学取X的溶液,酸化后加入KI淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 、 。
⑶写出Cl2将Z氧化为K2EO4的化学方程式: 。
 ⑷由E制备的E(C5H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为:
⑷由E制备的E(C5H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: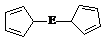 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有
种峰,错误的结构有 种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有
种峰,错误的结构有 种峰。
32.(10分)KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可
表述为:
□KClO3+□HCl(浓) ― □KCl +□Cl2↑+□ClO2↑+□
(1)配平化学方程式并标出电子转移的方向和数目(未知物化学式和系数填入框内)
(2)浓盐酸在反应中显示出来的性质是_______(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的量为_________。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位物质的量
得到的电子数表示)是Cl2的_______倍。
31.(10分)提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
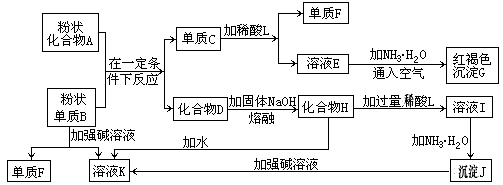
(1) 单质F是_________________ ____。 (2)写出由E生成G的离子反应方程式(或化学方程式)__________ ______________。 (3)溶液I中所含金属离子是_____________________。 (4)由C→ E + F若改用浓酸,则不能选用的浓酸是(写分子式)__________、__________。
30.向50mL 18 mol/L H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4
的物质的量( )
A.小于0.45 mol B.等于0.45 mol
C.在0.45 mol和0.90 mol之间 D.大于0.90 mol
第Ⅱ卷(非选择题:4小题,共40分)
29.将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为( )
A.1:2:3 B.3:2:1 C..6:3:1 D.6:3:2
28.下列离子方程式正确的是( )
A.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
B.明矾溶液中加入氢氧化钡溶液,使其产生沉淀的物质的量达最大值:
Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
C.Mg(HCO3)2溶液中加入过量石灰水:
Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓
D.向100 mL 0.1 mol/L的FeBr2溶液中通入0.012 mol Cl2:
10Fe2++14Br-+12Cl2=10Fe3++7Br2+24Cl-
27.对于反应4FeS2+11O2  2Fe2O3+8SO2,下列叙述正确的是( )
2Fe2O3+8SO2,下列叙述正确的是( )
A.铁和硫两种元素被还原 B.只有硫元素被氧化
C.转移电子总数是44e- D.Fe2O3为氧化产物,SO2为还原产物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com