
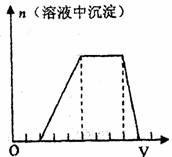
23.(7分)某溶液可能含有H+、Na+、NH+4、Mg2+、Fe3+、
Al3+、SO2-4等离子,当向该溶液中加入某浓度的NaOH
溶液时,发现生成沉淀的物质的量随NaOH溶液体积变
化如图所示,由此可知,该溶液中肯定含有的阳离子是
;且各离子的物质量之比为
;肯定不含的阳离子是 。
22.(6分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。当它们混
合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸敢,放出256.652kJ的热量。
(1)该反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g);ΔH=44 kJ·mol-1,则16g液态肼与液态过氧化氢反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点
 。
。
21.(9分)X、Y、Z三种元素,X与氢气能形成气态XH4,其中X的质量分数为75%,且X与Y能形成XY2型化合物。Y的核内质子数和中子数相等,在Y的氢化物中,Y的质量分数为88.9%,Z的最高价氧化物的水化物是酸性最强的酸。
(1)X元素所形成的同素异形体中硬度最大的是 (填名称),它属于 晶体。
(2)Y的氢化物属于 晶体,它的电子式是 。
(3)Z元素位于周期表第 周期第 族,它的氢化物是 (填“极性”或“非极性”)分子。
(4)X与Z形成的化合物其分子的空间构型是 ,它的晶体属于 晶体。
20. 已知72K时,2SO2(g)+O2(g) 2SO3(g);△H=-197kJ/mol。在相同温度下向密闭容器中通入1molSO2和0.5molO2达到平衡时放出热量Q1,在相同温度下,向同样容积的密闭容器中通入2molSO2、1molO2,达到平衡时放出热量Q2,则下列关系正确的是 ( )
已知72K时,2SO2(g)+O2(g) 2SO3(g);△H=-197kJ/mol。在相同温度下向密闭容器中通入1molSO2和0.5molO2达到平衡时放出热量Q1,在相同温度下,向同样容积的密闭容器中通入2molSO2、1molO2,达到平衡时放出热量Q2,则下列关系正确的是 ( )
A.2Q1=Q2 B.2Q1>Q2 C.Q1<Q2<197kJ D.Q1=Q2<197kJ
第Ⅱ卷(主观题,共60分)
19.下列说法正确的是(NA为阿伏加罗常数) ( )
A.124g白磷含有P-P键的个数为4NA
B.12g金刚石中含C-C键的个数为1.5NA
C.12g石墨中含有六元环的个数为NA
D.60gSiO2中含有Si-O键的个数为4NA
18.下列各组离子在指定溶液中能大量共存的是 ( )
①无色溶液中K+、Na+、MnO-4、SO2-4
②pH=1的溶液中CO2-3、Na+、AlO-2、NO-3
③加入Al能放出H2的溶液中Cl-、HCO-3、SO2-4、NH+4
④由水电离的C(OH)-=10-13mol/L的溶液中,Na+、Ba2+、Cl-、Br-
⑤有较多的Fe3+的溶液中,Na+、NH+4、SCN-、HCO-3
⑥酸性溶液中Fe3+、Al3+、NO-3、I-、Cl-
A.①② B.③⑥ C.②④ D.③⑤
17.Cu2S与一定浓度的HNO3反应生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1:1时,实际上参加反应的Cu2S与HNO3的物质的量之比为
( )
A.1:7 B.1:9 C.1:5 D.2:9
16.超氧化钾(KO2)的晶体结构与NaCl相似,下列对
KO2晶体结构的描述中正确的是 ( )
A.和阳离子距离相同且最近的阴离子共有8个
B.和阳离子距离相同且最近的阴离子共有6个
C.KO2的晶体中阴、阳离子个数比为1:1
D.与阳离子相邻的阴离子形成的几何形状为正四面体
15.如图所示,图中每条折线表示周期表IA-VIIA族中
的某一族元素氢化物沸点变化,每个小黑点代表一种
氢化物,其中a点代表的是 ( )
A.H2S B.HCl
C.PH3 D.SiH4
14.关于氢键的下列说法正确的是 ( )
A.每一个水分子内含有两个氢键
B.冰、水和水蒸气都存在氢键
C.H2O是一种非常稳定的化合物,这是由于氢键所致
 D.水的沸点比H2S高说明冰熔化时晶体中氢键只有部分破坏
D.水的沸点比H2S高说明冰熔化时晶体中氢键只有部分破坏
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com