
1. 集合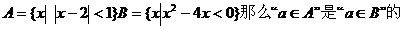 。
。
A.充分不必要条件 B.必要不充分条件 C.充要条件 D.既不充分也不必要条件
21.(12分)在一定温度下,向一个容积不变的密闭容器中加入 2 molA 和 2 molB ,发生反应:2A(g) + B(g) 3C( g)
ΔH=-a
kJ/mol(a>0),达到平衡时放出的热量为 bkJ,B的体积分数为ω1%。试回答:
3C( g)
ΔH=-a
kJ/mol(a>0),达到平衡时放出的热量为 bkJ,B的体积分数为ω1%。试回答:
(1)该反应平衡常数K表达式为________________________。 a与b的关系是a b(填“>”、“<”、“=”)。
(2)若升高温度,平衡常数K__________(填“增大”、“减小”或“不变”,下同),达到平衡时B的体积分数_________。
(3)下列说法中能表明该反应已达到平衡状态的是_________。
A.温度和体积一定时,容器内压强不再变化
B.温度和体积一定时,某一物质浓度不再变化
C.条件一定,混合气体的平均相对分子质量不再变化
D.温度和压强一定时,混合气体的密度不再变化
(4)若向上述平衡体系中再充入1 molB 和3 molC,在相同条件下达到平衡时B的体积分数为ω2 %,则ω1% ω2 % (填“>”、“ =”或“<”),理由是 。
江西吉安一中2010-2011学年上学期高三开学模拟考试
20.(12分)高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备路线如下:

试回答下列问题
(1)操作①搅拌的目的是: 。
(2) 操作②与操作③相同,该操作名称是:___________________。
(3)反应器中,NaOH、NaClO及Fe(NO3)3反应的离子方程式为: _______________________。
(4)次氯酸钠浓度对高铁酸钾产率有一定影响,当高铁酸钾产率最高时,NaClO的物质的量浓度约为_________。(计算结果保留一位小数)
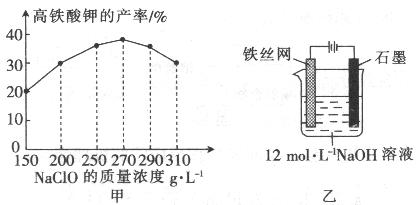
(5)从环境保护的角度看,制备中间产物Na2FeO4较好的方法为电化学法,其装置如图乙所示,则阳极的电极反应式为 。
19. (9分) 已知在同一碳原子上连有两个羟基的化合物是极不稳定的,它会自动脱去一分子水生成含有羰基的化合物。化合物A为苯的同系物,aLA的蒸汽完全燃烧消耗相同状况下O2 9aL。关于A的一系列转化关系如图所示。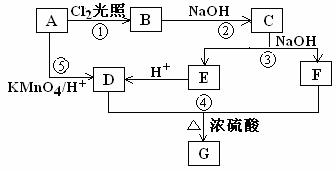
其中C能发生银镜反应,并且C在浓碱条件下可以发生自身氧化还原反应生成E和F。回答有关问题
(1)反应①②③④⑤中,不属于取代反应的有___________________(填序号)。
(2)B是反应①的产物之一,写出反应①的其他可能产物中摩尔质量为195.5g/mol的结构简式__________________。
(3)写出反应④的化学方程式_____________________________________。
(4)G属于芳香酸苯酚酯类的同分异构体有______种,写出其中任意一种的结构简式____________。
18. (10分)2007年诺贝尔化学奖获得者格哈德·埃特尔建立了合成氨反应机制。T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ·mol-1(注:图中“吸”表示在催化剂表面的吸附)。请回答下列问题:
(1)合成氨反应的机理为
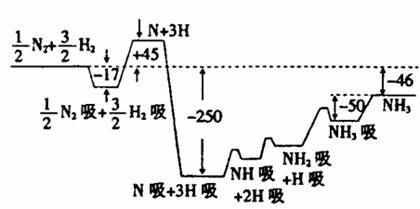
①
②N2 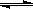 N2吸
N2吸 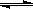 2N
2N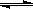 2N吸
2N吸
③N吸+H吸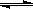 NH吸
NH吸
④NH吸+H吸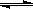 NH2吸
NH2吸
⑤NH2吸+H吸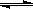 NH3吸
NH3吸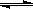 NH3
NH3
(2)T=673K,合成氨反应的热化学方程式为 。
(3)液氨和水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为2NH3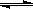
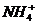 +
+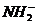 (某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=_________________。
(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=_________________。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物。它易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式_________________。
17.(9分)某化学兴趣小组对生石灰与水反应是显著放热反应进行了实验探究,在除了用手触摸试管壁感觉发热外,还设计了下列几个可行性方案。
甲方案:将温度计与盛放有生石灰的小试管用橡皮筋捆绑在一起,放入有水的小烧杯中,用胶头滴管向小试管中缓缓滴入水,看到的现象是 ,说明反应放热。(下列装置中支撑及捆绑等仪器已略去)

乙方案:将盛放有生石灰的小试管插入带支管的试管中,支管接①或②,用胶头滴管向小试管中缓缓滴入水,看到的现象是(接①) ,(接②) ,说明反应放热。
丙方案:用胶头滴管向盛放有生石灰且带支管的试管中滴加水,支管接的导管中盛适量无水硫酸铜粉末,看到的现象是 ,说明反应放热,其原因是 。
16.某温度下,向一洁净干燥的烧杯中加入56gFe粉,然后加入400
mL 16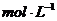 浓HNO3,反应过程中产生气体的体积和反应时间的关系如图所示,最后固体全部溶解,气体体积均在标准状况下测定。假设反应中HNO3的还原产物只有NO和NO2,那么理论上从哪一时刻开始产生NO( )
浓HNO3,反应过程中产生气体的体积和反应时间的关系如图所示,最后固体全部溶解,气体体积均在标准状况下测定。假设反应中HNO3的还原产物只有NO和NO2,那么理论上从哪一时刻开始产生NO( )
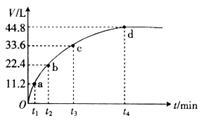
A.t1 B.t2 C.t3 D.t4
第Ⅱ卷(非选择题52分)
15.200℃时,11.6 g CO2和水蒸气的混合气体与过量的Na2O2充分反应后,固体质量增加了3.6 g,再将反应后剩余固体冷却后加入含有Na+、HCO、SO、CO等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是 ( )
A.原混合气体的平均摩尔质量为23.2 g/mol
B.混合气体与Na2O2反应过程中电子转移的物质的量为0.25 mol
C.溶液中SO的物质的量浓度基本保持不变
D.溶液中HCO的物质的量浓度减小,CO的物质的量浓度增大,但是HCO和CO的物质的量浓度之和基本保持不变
14.如图:在一个容积固定的恒温器中,有两个可左右滑动的密封隔板,在A、B、C处分别充入等质量的X、H2、Y两种气体,当隔板静止时,X和Y内的气体密度相等,下列说法正确的是( )
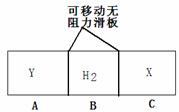
A.X的相对分子质量等于Y的相对分子质量 B.X的相对分子质量比Y的相对分子质量小
C.气体的体积:v(X)>v(H2)>v(Y) D.物质的量:n(X)<n(H2)<n(Y)
13.向某碳酸钠溶液中逐滴加1 mol·L─1的盐酸,测得溶液中Cl─、HCO3─的物质的量随加入盐酸体积的关系如图所示,其中n2:n1=3:2,则下列说法中正确的是 ( )
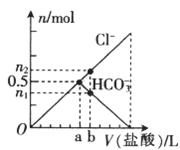
A.Oa段反应的离子方程式与ab段反应的离子方程式相同
B.该碳酸钠溶液中含有1mol Na2CO3
C.b点的数值为0.6
D.b点时生成CO2的物质的量为0.3 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com