
6.某溶液中含有NH4+、H+、SO42-、和OH-四种离子,对该溶液的判断一定正确的是
A.该溶液可能呈酸性,也可能呈碱性或中性
B.只可能是硫酸铵和硫酸的混合溶液或硫酸铵和氨的混合溶液
C.离子浓度由大到小的顺序是 C(NH4+)>C(SO42-)>C(H+)>C(OH-)
D.离子浓度有下列关系C(NH4+)+ C(H+) = C(OH-) + C(SO42-)
5.关于酸碱性和pH的说法中错误的是
A.猕猴桃吃起来是很酸的,所以它属于酸性食物
B.蛋白质在人体内经消化后生成碳酸、尿酸、硫酸等,故它属于酸性食物
C.有pH=0的溶液存在,但c(H+)=0的溶液却一定不存在
D.pH=6的某溶液中,c(OH-)可能为1.0×10-6mol/L
4.pH=1的两种一元酸HX与HY溶液,分别取50mL加入足量的镁粉,充分反应后,收集到H2体积分别为V(HX)和V(HY)。若V(HX)>V(HY),则下列说法正确的是
A.HX可能是强酸
B.HX的酸性比HY的酸性弱
C.两酸的浓度大小c(HX)<c(HY)
D.将两种一元酸均稀释100倍,稀释后两溶液的pH均为3
3. 室温下,甲溶液中水电离出的H+浓度为10-12mol/L,乙溶液中水电离出的H+浓度为
10-2 moL/L,下列说法正确的是w.w.^w.k.s.5*
A.甲乙两溶液的pH不可能相同
B.甲乙两种溶液中加入Al粉都一定会产生H2
C.HSO3-不可能在甲、乙两溶液中大量共存
D.甲不可能是盐溶液,乙不可能是酸或碱溶液w.w.^w.k.s.5*
2.Fe(OH)3难溶于水,存在平衡:Fe(OH)3 Fe3++3
Fe3++3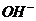 ,在Fe(OH)3悬浊物中加入少量下列物质后,可使溶液中的Fe3+浓度增大的是
,在Fe(OH)3悬浊物中加入少量下列物质后,可使溶液中的Fe3+浓度增大的是
A.NaOH溶液 B.稀HCl C.稀HI D.水
1.下列有关结论中,正确的是
A. 浓度为0.1 mol·L-1CuSO4溶液,温度升高,溶液的pH降低
B. 一元酸与一元碱恰好完全反应后的溶液中一定存在c(H+)=c(OH-)
C. 将pH = 4的盐酸稀释后,溶液中所有离子的浓度均降低
D. 在所有能够溶解Al(OH)3的溶液中,Cu2+、ClO-、Cl-、Ca2+一定能够大量共存
2.下列叙述正确的是
 A. 0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
A. 0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
 B. Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
B. Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
 C. pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
C. pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等

 D. 在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
D. 在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
[解析]A项,苯酚钠为碱性溶液,故错;B项,温度不变,则Kw是不变的,错;C项,pH=5即代表溶液中C(H+)均为10-5mol/L,错。D项,Ag2S比AgCl更难溶,故加入S2-会与溶液中的Ag+结合的,正确 答案D。
答案D。
[随堂训练][1-12为单选,13-16为双选]
1.下列叙述正确的是
 A.0.1mol·L-1氨水中,c(
A.0.1mol·L-1氨水中,c(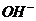 )==c(NH4+)
)==c(NH4+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1mol·L-1CH3COONa溶液中,c(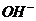 )==c(CH3COOH)+c(H+)
)==c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)==2c(A2-)+c(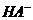 )+c(H2A)
)+c(H2A)
[解析]NH3·H2O是弱电解质,它本身电离所产生的两种离子浓度相等,得氨水中的部分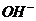 来自于H2O的电离,所以c(OH-)>c(NH4+),A错;B项中酸碱中和反应后,c(OH-)=0.01mol/L,pH=-lgc(H+)=-lg(10-14/10-2)=12,B正确;根据盐的消解规律,可以判断C正确;D项中因钠元素的离子与A原子的物质的量之比为1∶1,对应关系应该为c(Na+)=c(A2-)+c(
来自于H2O的电离,所以c(OH-)>c(NH4+),A错;B项中酸碱中和反应后,c(OH-)=0.01mol/L,pH=-lgc(H+)=-lg(10-14/10-2)=12,B正确;根据盐的消解规律,可以判断C正确;D项中因钠元素的离子与A原子的物质的量之比为1∶1,对应关系应该为c(Na+)=c(A2-)+c(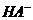 )+c(H2A),D错。答案BC。
)+c(H2A),D错。答案BC。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com