
7.下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是
|
编号 |
化学反应 |
离子方程式 |
评价 |
|
A |
碳酸钙与 醋酸反应 |
CO32-+2CH3COOH = CO2↑+H2O+2CH3COO- |
错误。碳酸钙是弱电解质,不应写成离子形式 |
|
B |
苯酚钠溶液中 通入少量CO2 |
2C6H5O-+ CO2 + H2O
→ CO32- +2C6H5OH |
正确。 |
|
C |
NaHSO3的水解 |
HSO3-+H2O SO32-+H3O+ SO32-+H3O+ |
错误。水解方程式误写成电离方程式 |
|
D |
等物质的量的 FeBr2和Cl2反应 |
2Fe2++2Br-+2Cl2 = 2Fe3++Br2+4Cl- |
错误。Fe2+与Br-的物质的量之比与化学式不符 |
6.某无色溶液中只可能含有①Na+ 、②Ba2+、 ③Cl-、 ④Br-、⑤SO32-、⑥SO42- 离子中的若干种(忽略水电离出的H+、OH),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
|
步骤 |
操作 |
现象 |
|
(1) |
用pH试纸检验 |
溶液的pH大于7 |
|
(2) |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙色 |
|
(3) |
向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
|
(4) |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是
A.肯定含有的离子是③④⑤ B.肯定没有的离子是②⑤
C.可能含有的离子是①⑥ D.不能确定的离子是③⑥
5. 下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Na+、Cr2O72-、SO42-
②pH=11的溶液中:CO32-、Na+、NO3-、Al(OH)4-
③加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、Mg2+
④在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤在溶液中能大量共存,加入NaOH后加热既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、AlO2-
⑥能使酚酞变红色的溶液:Na+、C1-、S2-、SO32-
A.①③⑤ B.②④⑤ C.②④⑥ D.④⑤⑥
4.下列离子方程式书写正确的是
A.AgCl沉淀在氨水中溶解:AgCl+2NH3·H2O====Ag(NH3)2+ + Cl-+2H2O
B.碳酸氢钡溶液中加入过量氢氧化钠溶液: Ba2+ +HCO3-+OH-=BaCO3↓+H2O
C.氨气通入醋酸溶液中: NH3+H+=NH4+
D.向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
3.常温下,下列溶液中可能大量共存的离子组是
A.加入金属镁能产生H2的溶液中:Na+、Fe3+、SO42-、NO3-
B.含有大量Fe2+的溶液中:K+、Mg2+、ClO-、SO42-
C.能使Al3+生成沉淀的溶液中:NH4+、Na+、SiO32-、HCO3-
D.水电离产生的c(OH-)=1×10-10mol/L的溶液中:Al3+、SO42-、NO3-、Cl-
2.能正确表示下列反应离子方程式的是
A.过氧化钠固体与水反应:2O22-+2H2O == 4OH-+O2↑
B.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.向次氯酸钠溶液中通入少量SO2:ClO-+SO2+H2O=Cl-+SO42-+2H+
D.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
1.下列离子方程式中正确的是
A. 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:
Ba2+ + OH- + H+ + SO42- = BaSO4↓+ H2O
B.NH4HCO3溶液与过量KOH浓溶液共热:NH4++
OH- NH3↑+ H2O
NH3↑+ H2O
C.稀硝酸和过量的铁屑反应:3 Fe + 8H+ +2 NO3- = 3 Fe3+ +2 NO↑ + 4 H2O
D.KI溶液与H2SO4酸化的H2O2溶液混合:2 I- + H2O2 + 2 H+ =2 H2O + I2
2. 在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液: Na+、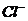 、
、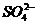 、Fe3+
、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、 、
、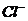
C.c(H+)=10-12
mol·L-1的溶液:K+、Ba2+、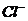 、
、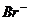
D.碳酸氢钠溶液:K+、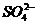 、
、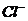 、H+
、H+
 [解析]选项A中使酚酞溶液呈红色,则溶液必定呈碱性,则OH-与Fe3+不能共存;选项B中使紫色的石蕊试液变红的溶液呈酸性,NO3-在酸性溶液中具有强氧化性与Fe2+不能共存;选项C中c(H+)=10-12
mol·L-1的溶液呈碱性,在碱性溶液中,这些离子均能共存;选项D中
[解析]选项A中使酚酞溶液呈红色,则溶液必定呈碱性,则OH-与Fe3+不能共存;选项B中使紫色的石蕊试液变红的溶液呈酸性,NO3-在酸性溶液中具有强氧化性与Fe2+不能共存;选项C中c(H+)=10-12
mol·L-1的溶液呈碱性,在碱性溶液中,这些离子均能共存;选项D中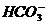 与H+不能共存。答案:C。
与H+不能共存。答案:C。
[随堂训练][1-8为单选,9-10为双选]
1、能正确表示下列反应的例子方程式是( )
A.向次氯酸钙溶液通入过量CO2:Ca2++2 ClO-+CO2+H2O =CaCO3↓+2HClO
B.足量的CO2通入饱和碳酸钠溶液中
CO2+CO32-+H2O=2HCO3-
C.氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++ OH-=CaCO3↓+H2O
D.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++ NH4+ =3Fe3++NO↑+2H2O
[解析]A选项CO2过量,应该生成HCO3-方程式应为:ClO-+CO2+H2O=HClO+ HCO3-;B选项生成NaHCO3应该沉淀析出,正确的方程式为:CO2+CO32-+H2O+2Na+=2NaHCO3↓;C选项要考虑到Mg(OH)2 为沉淀即可, Mg2++2 HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O 。答案D。
3. 解答离子共存的选择题,首先要看清题干要求:一是判断离子共存,还是判断不共存;二要看题目中的隐含条件:碱性、酸性、无色透明、pH为多大;三看离子间是否发生氧化还原反应、复分解反应等。总之,要注意审清题意,充分挖掘出题设的隐含条件;要把离子自身的特点同题干中给定的限制条件结合起来分析。
 (1)注意溶液隐含的酸碱性,如酸性溶液(H+ )、碱性溶液(OH-)、使酚酞试液变红的溶液、使紫色石蕊试液变红的溶液、c(H+)=10-12
mol·L-1的溶液、由水电离出c(H+)=10-12
mol·L-1溶液、投入铝产生氢气的溶液、在pH=13的无色溶液中等。
(1)注意溶液隐含的酸碱性,如酸性溶液(H+ )、碱性溶液(OH-)、使酚酞试液变红的溶液、使紫色石蕊试液变红的溶液、c(H+)=10-12
mol·L-1的溶液、由水电离出c(H+)=10-12
mol·L-1溶液、投入铝产生氢气的溶液、在pH=13的无色溶液中等。
(2)注意无色溶液和有色离子不匹配,常见的有色离子有:Fe3+(黄色) 、Cu2+ (蓝色)、Fe2+(浅绿色)、MnO4-(紫色)。
(3)注意溶液中隐含的氧化性离子与还原性离子不能共存。如Fe3+与S2-、I-,MnO4-与I-,NO3- (H+)与Fe2+等。
[典例精析]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com