
25.(12分)为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验
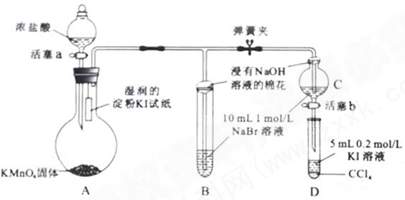
实验过程:Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。 Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。 Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。 Ⅳ.…… (1)A中产生黄绿色气体,其电子式是 。 (2)验证氯气的氧化性强于碘的实验现象是 。 (3)B中溶液发生反应的离子方程式是 。 (4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 。 (5)过程Ⅲ实验的目的是 。 (6)氯、溴、碘单质的氧化性逐渐减小的原因:同主族元素从上到下 ,得电子能力逐渐减弱。
24.(10分)W、X、Y、Z是原子序数依次增大的短周期元素。 ①X元素可形成X2-离子 ②1 mol Y元素的单质跟酸完全反应,能置换出 1 g H2,这时Y转化为与X2-具有相同电子层结构的离子 ③Z元素原子的最外层电子数是K层电子数的两倍 ④X可以与W、Z形成W2X、W2X2、ZX2等共价化合物 请回答:(1)写出Y离子的结构示意图: . (2)X元素位于周期表第 周期第 族. (3)Y与X也可形成原子个数比为1∶1的化合物,该化合物的电子式为: (4)ZX2在高温下能发生很多化学反应,它是一种重要的工业原料,请用化学方程式表示它在工业上的一种重要用途: 。
23.(10分)下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题。
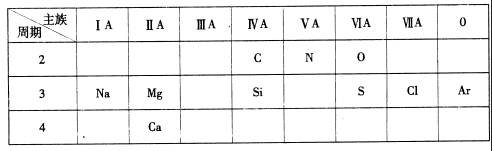 (1)第3周期中金属性最强的元素是
(填元素名称);
(2)S原子结构示意图为
;
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是 (填化学式);
(4)C、N和O原子半径由小到大的顺序的是
;
(5)第3周期中气态氢化物最稳定的是
;
(6)Si是带来人类文明的重要元素之一,其氧化物化学式是 ,常用于制造
(填一种高性能的现代通讯材料的名称);
(7)铝是大自然赐予人类的宝物。它其中的一个用途是作为铝热剂,该反应的化学方程式为
(8)N元素形成的一种氢化物的化学式是
,俗话说“雷雨发庄稼”,请写出二氧化氮溶于水的反应
(1)第3周期中金属性最强的元素是
(填元素名称);
(2)S原子结构示意图为
;
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是 (填化学式);
(4)C、N和O原子半径由小到大的顺序的是
;
(5)第3周期中气态氢化物最稳定的是
;
(6)Si是带来人类文明的重要元素之一,其氧化物化学式是 ,常用于制造
(填一种高性能的现代通讯材料的名称);
(7)铝是大自然赐予人类的宝物。它其中的一个用途是作为铝热剂,该反应的化学方程式为
(8)N元素形成的一种氢化物的化学式是
,俗话说“雷雨发庄稼”,请写出二氧化氮溶于水的反应
22.(8分)实验室要配制1mol/L的稀硫酸250mL,回答下列问题: (1)需要98%密度为1.84g/cm3的浓硫酸 mL (2)配制时,必须使用的仪器有 (填代号) ①烧杯 ②100 mL量筒 ③20 mL量筒 ④1000 mL容量瓶 ⑤250 mL容量瓶 ⑥托盘天平(带砝码) ⑦玻璃棒 ;还缺少的仪器是 。 (3)配制时,该实验两次用到玻璃棒,其作用分别是 、 。 (4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“无影响”)①没有洗涤烧杯和玻璃棒。 。 ②如果加水超过了刻度线,取出水使液面恰好到刻度线。 。 ③容量瓶没有干燥。 。
21.(10分)A、B、C、D是四种可溶的化合物,分别由阳离子 和阴离子
和阴离子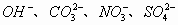 两两组合而成,它们的溶液可发生如下反应:
两两组合而成,它们的溶液可发生如下反应:
A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失;A与D反应生成有色沉淀,B与C反应生成白色沉淀和气体。
根据实验现象,按要求回答下列问题:
(1)写出它们的化学式:A. ________,B. ________,C. ________,D. ________。
(2)写出B与C反应的离子方程式:________________________________________。
20、有一硫酸和硝酸的混合溶液,取出其中的10mL,加入足量氯化钡溶液,将生成的沉淀滤出洗净,烘干称得质量为9.32g;另取这种溶液10mL与4mol/L的NaOH溶液25mL恰好完全中和,再取10mL混合溶液与0.96g铜粉共热,有多少毫升气体产生?(标准状况下)
A.112mL B.224mL
C.448mL D.560mL
第Ⅱ卷(填空题,共50分)
19.做实验时不小心粘了一些高锰酸钾,皮肤上的斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为: MnO+C2O+H+―→CO2↑+Mn2++,关于此反应的叙述正确的是( )
A.该反应的氧化剂是C2O
B.该反应右边方框内的产物是OH-
C.该反应电子转移总数是5e-
D.配平该反应式后,H+的系数是16
18.根据反应:2H2S+O2===2S↓+2H2O,4NaI+O2+2H2SO4===2I2+2Na2SO4+2H2O,Na2S+I2===2NaI+S↓.下列物质的氧化性强弱判断正确的是( )
A.O2>I2>S B.H2S>NaI>H2O
C.S>I2>O2 D.H2O>NaI>H2S
17.三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O===2NO+HNO3+9HF.下列有关说法正确的是( )
A.NF3是氧化剂,H2O是还原剂
B.还原剂与氧化剂的物质的量之比为2∶1
C.若生成0.2 mol HNO3,则转移0.2 mol电子
D.NF3在潮湿的空气中泄漏会产生红棕色气体
16.某强酸性溶液中可能存在NO、I-、Cl-、Fe3+中的一种或几种,向该溶液中加入溴水后,溴被还原,由此推断该溶液中 ( )
A.不含NO,也不含I- B.含有NO、I-、Cl-
C.含I-,但不能确定是否含有Cl- D.含有Fe3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com