
16.(15分)用沉淀法测定NaHCO3和K2CO3混合物的组成。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应。实验记录见下表:
|
实验次数 |
称取样品的质量/g |
所加Ba(OH)2溶液的体积/L |
测得生成沉淀质量/g |
|
1 |
0.858 |
0.5 |
1.379 |
|
2 |
1.716 |
0.5 |
|
|
3 |
2.574 |
0.5 |
4.137 |
|
4 |
3.432 |
0.5 |
5.516 |
|
5 |
4.290 |
0.5 |
5.516 |
|
6 |
5.148 |
0.5 |
5.516 |
回答下列问题:
(1)写出少量NaHCO3和过量Ba(OH)2溶液反应的离子方程式:
____________________________________________________________
(2)第2次实验中产生沉淀质量是___________________g,
(3)样品中NaHCO3和K2CO3的物质的量之比是___________________;
(4)原Ba(OH)2溶液的浓度为___________________mol/L
(5)室温下取第3组实验所得溶液体积的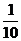 ,加水配成500mL溶液,则稀释以后溶液的pH为___________________
,加水配成500mL溶液,则稀释以后溶液的pH为___________________
2009年济源一中9月份月考化学试卷
14.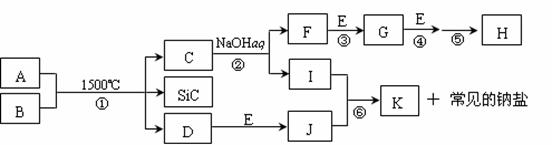 (12分)下图是一些常见元素的单质或化合物之间的转化关系。溶液中的水以及部分反应物或生成物未标出。A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,且和SiC具有相同的价电子数和原子数,J是一种能引起温室效应的气体,K是两性化合物。反应③、④、⑤用于工业中生产H。回答下列问题:
(12分)下图是一些常见元素的单质或化合物之间的转化关系。溶液中的水以及部分反应物或生成物未标出。A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,且和SiC具有相同的价电子数和原子数,J是一种能引起温室效应的气体,K是两性化合物。反应③、④、⑤用于工业中生产H。回答下列问题:
(1)写出下列物质的化学式:F_________,I________,H________;
(2)写出反应③的化学方程式:________________________;
(3)写出反应⑥的离子方程式:________________________;
(4) B和SiC的纳米级复合粉末是新一代大规模集成电路理想的散热材料。反应①是科学家研究开发制备该纳米级复合粉末的最新途径。已知B由Si及另外两种元素组成,且Si与另外两种元素的物质的量之比均为1∶4,写出反应①的化学方程式:__________________________________________。
15(11分)一种澄清透明的溶液中可能含有下列离子:K+、Fe3+、Ba2+、Al3+、NH4+、Cl-、I-、NO3-、HCO3-、SO32-、SO42-现做以下实验:
(1)将溶液滴在蓝色石蕊试纸上,试纸呈红色
(2)取少量溶液,加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀
(3)将(2)的沉淀过滤。由滤液中加入硝酸银溶液,产生白色沉淀
(4)另取溶液,逐滴加入氢氧化钠溶液至过量,只观察到有红棕色沉淀生成,且沉淀量不减少。由此可以推断:
溶液中肯定存在的离子有:______________________________________。
溶液中肯定不存在的离子有:____________________________________。
溶液中还不能确定是否存在的离子有:______________________________。
12.设NA表示阿伏加德罗常数,下列叙述中正确的是
(
)
A.常温常压下,31g白磷中所含有的共价键数目为6NA
B.足量MnO2与100mL 10mol·L-1的浓盐酸反应,则生成氯气分子为0.25NA
C.标准状况下,22.4L CH3Cl和CHCl3的混合物所含有分子数目为NA
D.92g
NO2和 N2O4的混合物中所含有原子数为6NA
第二卷 填空题(共48分)
13(10分)某校研究性学习课外环保小组对采集气体样品中所含污染气体CO的浓度进行测定,其方法与步骤如下: 
①先使采集的气体样品2.00L缓缓通过含I2O5的加热管,发生反应:
CO + I2O5 → CO2 + I2
②将产生的I2升华,并由浓度为0.005mol•L―1的Na2S2O3溶液30.0mL完全吸收,此时发生反应:I2 +2S2O32― =2 I― + 2S4O62―

③向②的溶液中加4滴淀粉溶液作指示剂,用浓度为0.01mol•L―1的I2水滴定多余的Na2S2O3,耗去5.00mL的溶液恰好变色。
(1)操作③中,滴定终点时溶液由___________色变为_________色。若在用I2水滴定操作读数时,滴定前仰视将会导致测得的CO浓度_________(填“偏高” 、“偏低” 、“不影响” )。
(2)步骤①中由CO与I2O5反应生成I2的物质的量是____________mol。
(3)该气体样品中CO的浓度为____________mg•L―1
11.一定温度下,mg某物质在足量氧气中充分燃烧,将其产物立即与过量的Na2O2固体充分反应,固体质量增加了ng,且m<n,在①H2 ②CO ③CO2 ④CH3COOH ⑤CH3CHO
⑥C2H4中,符合题意的是
(
)
A.只有③
B.只有①②④ 
C.只有⑤⑥
D.全都符合
10.已知钡(Ba)的活动性是处于Na、K之间,则下列实验(现象)正确的是
A.Ba可从KCl溶液中置换出钾
( )
B.Ba可从冷水中置换出H2
C.在溶液中Ba2+可氧化Zn成为Zn2+
D.Ba投入到NaOH溶液中,没有明显的现象发生
9.下列各组离子在碱性溶液中能大量共存,且无色透明,加酸酸化后溶液变色,但无沉淀、无气体生成的是
( )
A.
Fe2+、I-、ClO-、SO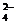

B.Br-、K+、SO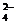 、BrO
、BrO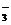

C.S2-、SO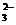 、K+、SO
、K+、SO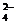

D.Ca2+、Cl-、H2PO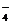 、Na+
、Na+
8、将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
( )
A.c(HCN)<c(CN-) a+)>c(CN-)
C.c(HCN)-c(CN-)=c(OH-)
D.c(HCN)+c(CN-)=0.2mol·L-1
7、通常把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H)。下面列举了一些化学键的键能数据,供计算用:
|
化学键 |
Si-Cl |
H-H |
Si-Si |
H-Cl |
|
键能:kJ/mol |
360 |
436 |
176 |
431 |


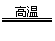 工业上高纯硅可以通过下列反应制取:SiCl4(g)+2H2(g)
Si(s)+4HCl(g),
工业上高纯硅可以通过下列反应制取:SiCl4(g)+2H2(g)
Si(s)+4HCl(g),
该反应的反应热△H为:
( )
A.+412
kJ/mol
B.-412kJ/mol 
C.+236
kJ/mol
D.-236 kJ/mol
6、下列说法或表示方法正确的是
( )
A.在稀溶液中,H+(aq)+ OH-(aq)= H2O(l);△H =-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1
mol NaOH的溶液混合,放出的热大于57.3 kJ
B. 由C(石墨)= C(金刚石);△H = +1.90 kJ·mol-1可知金刚石比石墨稳定
C. 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
D. 在101 kPa时,2 g
H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+ O2(g)= 2H2O(l);△H =-285.8 kJ·mol-1
5、还原2.4×10-3mol XO(OH)3+到X元素的低价态时,需消耗30mL0.2mol·L-1的亚硫酸钠溶液,则在此反应中X元素的低价态为
( )
A.
0价
B.+1价
C.-1价
D.-2价
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com