
4.在西方发达国家,人们在购物、旅游、劳务消费之后,总是习惯性地签发支票来偿付账目,卖方也乐意接受。支票之所以可以偿付账目并被卖方接受,是因为( )
①支票是活期存款的支付凭证
②支票是出票人委托银行支付一定金额给受款人或持票人的票据
③支票是最基本的结算方式 ④支票是最方便、最快捷的电子货币
A.①② B.③④ C.②③ D.②④
2008年美元对人民币汇率中间价简表
|
日期 |
6月10日 |
7月1日 |
8月1日 |
9月1日 |
|
1美元兑人民币 |
6.9199 |
6.8608 |
6.8432 |
6.8320 |
3. 某年上半年定期存款利率是3.78%(整存整取),同期居民消费价格指数(CPI)同比上涨了7.9%。小张年初存人了1万元半年定期存款,到期时 ( )
A.小张的货币购买能力上升 B.小张的货币购买能力下降。
C.小张的货币购买能力没有变化 D.CPI变化对小张没有任何影响
2. 货币是商品交换长期发展的产物,货币的本质是一般等价物。金、银充当货币后,可以与一切商品相交换,这表明( )
A.金、银作为货币后,就不再是商品
B.金、银作为货币后,代表着一种社会生产关系
C.金、银天然具有货币的社会属性
D.金、银作为货币,其购买力大小是不变的
1.据新华网消息,动画片《喜洋洋与大灰狼》走红后,各网站竞相推出《喜洋洋与大灰狼》的下载铃音,一般为2元每首。下载的彩铃是 ( )
A.商品,因为它既是劳动产品,又用于交换
B.非商品,因为它尽管是劳动产品,但没有用于交换
C.商品,因为它既有使用价值,又能满足不同人的需要
D.非商品,因为它尽管有使用价值,但没有价值
2.化学性质:
(1)与非金属反应:与强氧化剂反应生成Fe3+,与弱氧化剂反应生成Fe2+。
3Fe+2O2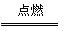 Fe3O4
Fe3O4
2Fe+3Cl2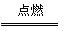 2FeCl3
2FeCl3
Fe+S FeS
FeS
(2)与水蒸气反应
3Fe+4H2O(g) 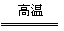 Fe3O4+4H2
Fe3O4+4H2
(3)与酸反应
a.与非氧化性酸反应
Fe+2H+====Fe2++H2↑
b.与氧化性酸反应
Fe+4HNO3(稀)====Fe(NO3)3+NO↑+2H2O(Fe不足)
3Fe+8HNO3(稀)====3Fe(NO3)2+2NO↑+4H2O(Fe过量)
(4)与某些盐溶液反应
Fe+Cu2+====Fe2++Cu
Fe+2Fe3+====3Fe2+
1.物理性质:纯净的单质铁为银白色,具有金属光泽,密度较大,熔点较高,易导电、导热,有良好延展性,质地较软的固体。可被磁化。
[师]请同学们打开元素周期表,要能够说出Fe元素在周期表中的位置及在地壳中的含量。
[学生看书后回答]Fe位于第四周期Ⅷ族,最外层有2个电子,容易失去最外层电子显+2价,次外层的一个电子也经常参加反应,故也常表现+3价。Fe元素在地壳中含量居第4位,仅次于铝。
[师]铁是一种历史悠久、应用最广泛、用量最大的金属。下面我们来学习它的性质。铁的物理性质我们早已在初中学习过,现在我们来共同回忆一下。
[板书]1.物理性质:纯净的单质铁为银白色,具有金属光泽,密度较大,熔点较高,易导电、导热,有良好延展性,质地较软的固体。可被磁化。
[师]铁的化学性质非常活泼,它能跟许多物质发生化学反应。下面我们着重学习Fe跟非金属单质、水、酸、盐溶液的反应。
[板书]2.化学性质
(1)铁跟非金属的反应
[师]在初中时,我们曾学过,灼热的铁丝在氧气里燃烧,生成黑色的四氧化三铁。那么,铁还能跟其他非金属反应吗?下面让我们共同做一个实验。
[演示实验4-7]指导同学们观察实验现象。
[生]我们可以观察到,铁丝在Cl2中燃烧,生成棕黄色的烟。加水振荡后,生成黄色溶液。
[思考]:燃烧是否必须有氧气参加?
答案:不一定。像Cu、Fe均可以在Cl2中燃烧,Mg可以在CO2中燃烧
[师]铁丝在Cl2中燃烧生成的棕色烟,是FeCl3的小颗粒,溶于水形成黄色溶液。请同学们写出化学反应方程式。
[板书]2Fe+3Cl2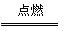 2FeCl3
2FeCl3
[投影练习]下列各离子组成在无色溶液中能大量共存的是( )
A.NO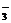 、NH
、NH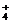 、Fe3+、Na+
B.NO
、Fe3+、Na+
B.NO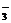 、Ag+、Cl-、K+
、Ag+、Cl-、K+
C.Cu2+、SO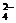 、H+、Cl- D.H+、Na+、Cl-、Ba2+
、H+、Cl- D.H+、Na+、Cl-、Ba2+
解析:Fe3+呈黄色,Cu2+呈蓝色,Ag+能与Cl-形成沉淀
答案D
[师]除此之外,Fe还能跟S、I2等非金属发生反应。我们在高一课本氧族元素的内容中学过Fe跟S的反应,请同学们给出反应方程式。
[生]Fe+S FeS
FeS
[师]请同学们标出Fe跟Cl2、S反应时化合价的变化情况,并讨论这两种非金属单质的氧化性的强弱。
[生]Fe与这两种物质发生化学反应时,化合价的变化不同。在Fe跟Cl2的反应里,Fe原子失去3个电子变成+3价的Fe。在Fe跟S的反应里,Fe原子失去2个电子变成+2价的Fe。
[讲述]在这两个反应中,Cl2、S是氧化剂,Cl2夺电子的能力强,它的氧化性强,S的氧化性相对较弱。
[问题探究]:O2跟Cl2、S相比,氧化性如何呢?
[生]因为Fe在O2中燃烧生成的是Fe3O4,Fe有两种价态,所以,O2的氧化能力较Cl2弱,而较S强。
[小结并板书]Fe与强氧化剂反应生成Fe3+,与弱氧化剂反应生成Fe2+,与中等能力的氧化剂反应生成Fe3O4。
[板书](2)铁跟水的反应
[师]在常温下,Fe跟H2O不起反应。但我们知道,在潮湿的地方铁制品易生锈。那是水和空气里的O2、CO2等共同作用的结果,其原理将在本章第四节学习。
那么,在高温下,Fe能不能跟水反应呢?下面,我们来共同完成一个实验。
[演示实验5-8]
[师]活泼金属与水作用时,生成对应的氢氧化物和H2,如:2Na+2H2O====2NaOH+ H2↑,若高温时则生成金属氧化物和氢气。铁与水反应生成的是Fe3O4。请同学们写出化学反应方程式,并指出氧化剂。
(学生回答,教师补充并板书)
3Fe+4H2O(g)  Fe3O4+4H2↑,H2O为氧化剂。
Fe3O4+4H2↑,H2O为氧化剂。
[师]你们在初中还学过铁的哪些性质?
[生]与酸反应
[板书](3)铁与酸的反应
[师]我们知道,酸有非氧化性酸和氧化性酸,这两种类型的酸与铁反应情况是不一样的。
[板书]①与非氧化性酸反应
[师]我们早已学过铁与稀盐酸及稀硫酸的反应,请同学们写出这两个化学方程式。
[生]Fe+2HCl====FeCl2+H2↑ Fe+H2SO4====FeSO4+H2↑
[板书]其反应实质是:Fe+2H+====Fe2++H2↑
[板书]②与氧化性酸反应
[师]Fe与氧化性酸(如稀HNO3)反应生成Fe3+,但如果Fe过量,Fe3+会与Fe反应生成Fe2+。其反应的化学方程式是:
[板书]Fe+4HNO3(稀)====Fe(NO3)3+NO↑+2H2O(Fe不足)
3Fe+8HNO3(稀)====3Fe(NO3)2+2NO↑+4H2O(Fe过量)
[讲解]分析铁与酸的反应,虽然酸都是作为氧化剂反应的,但稀盐酸、稀硫酸中起氧化性的是H+(2H++2e-====H2↑),而氧化性的酸则不同(如浓H2SO4起氧化性的是+6价的S),一般与金属反应不产生H2。有关这部分内容,我们在学习硫酸时已详细地介绍过,这里就不再重复了。需要强调的一点是,铁遇冷的浓硝酸、浓硫酸会发生钝化,即在铁表面生成致密的氧化物薄膜,阻止内部的金属进一步被氧化。因此常用铁制容器装运浓H2SO4、浓HNO3。
[板书](4)铁跟盐溶液的反应
[师]铁跟比它活动性弱的金属的盐溶液起反应时,能置换出这种金属。请同学们写出Fe放入CuSO4或CuCl2溶液中的离子方程式。
[板书]Fe+Cu2+====Fe2++Cu
[投影练习]将质量为m g的铁片放入CuSO4溶液中,过一会儿取出干燥,铁片质量变为n g,被氧化铁片的质量是( )
A.8(m-n)
B.8(n-m)
C.7(m-n)
D.7(n-m)
解析:Fe与CuSO4反应析出的铜将覆盖在铁的表面使其增重,从反应Fe+CuSO4====FeSO4+Cu来看,有56 g Fe被氧化,则增重64-56=8 g,现已知增重(n-m)g,则被氧化的铁片的质量是: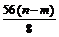
答案:D.
[师]Fe还可以与铁盐溶液发生反应,根据同种元素不同价态间的氧化还原反应,我们写出离子方程式。
[板书]Fe+2Fe3+====3Fe2+
[投影练习]在氯化铁和氯化铜的混合溶液中,加入过量的Fe粉,若充分反应后溶液的质量没有改变,则原混合溶液中Fe3+和Cu2+的物质的量之比为( )
A.14∶5 B.5∶14
C.7∶2 D.2∶7
答案:D
[小结]本节课重点讲铁的化学性质。
[布置作业]1.举例说明铁有哪些化学性质?
2.课本92页一、1;二、1、4
●板书设计
第二节 铁和铁的化合物
22. 解: ⑴由 得
得 ,即
,即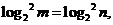
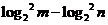 =0
=0
∴ 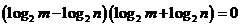
即 =1或
=1或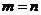 (与题目不符,舍去)
……………………4分
(与题目不符,舍去)
……………………4分
⑵证明:∵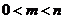 ,
, =1 ∴
=1 ∴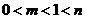
由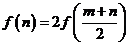 得
得 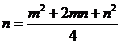
整理得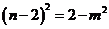 ∵
∵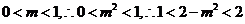
即
17、解:⑴由题义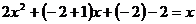
整理得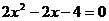 ,解方程得
,解方程得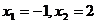 即
即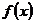 的不动点为-1和2. ⑵由
的不动点为-1和2. ⑵由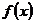 =
=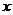 得
得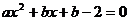
如此方程有两解,则有△=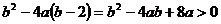
把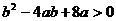 看作是关于
看作是关于 的二次函数,则有
的二次函数,则有
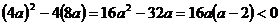 解得
解得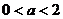 即为所求.
即为所求.
21 (1)取AB的中点M,连FM,MC,
∵ F、M分别是BE、BA的中点 ∴ FM∥EA, FM=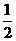 EA
EA
 ∵ EA、CD都垂直于平面ABC ∴ CD∥EA∴ CD∥FM
∵ EA、CD都垂直于平面ABC ∴ CD∥EA∴ CD∥FM
又 DC=a, ∴ FM=DC ∴四边形FMCD是平行四边形
∴ FD∥MC… FD∥平面ABC
(2) 因M是AB的中点,△ABC是正三角形,所以CM⊥AB
又 CM⊥AE,所以CM⊥面EAB, CM⊥AF, FD⊥AF,
因F是BE的中点, EA=AB所以AF⊥EB.
16、解:⑴D点坐标为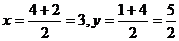 即D
即D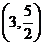
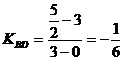
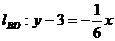 ,一般式为
,一般式为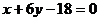
⑵由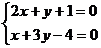 得圆心坐标为
得圆心坐标为
又半径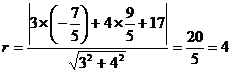
所以圆C的方程为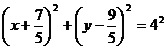 ……………………8分
……………………8分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com