
0.1mol/LBa(NO3)2、3%H2O2、10%NaOH溶液、蒸馏水、品红溶液;仪器自选。
(1)提出假设
假设一:固体全部是Na2SO3; 假设二:固体全部是Na2SO4;
假设三 。
(2)设计实验方案(略);从绿色环保的角度,最好选用下列中的 (填序号)进行实验:

(3)进行实验:请在下表中用简要文字写出实验操作、预期现象和结论。
|
实验步骤 |
预期现象和结论 |
|
步骤1: |
|
|
步骤2: |
|
|
步骤3: |
|
|
……… |
|
[课后训练] 《学海导航》p113-124
12.现有一瓶实验室放置已久的可能被氧化的Na2SO3固体,为了研究它的组成,请你参与同学们进行的如下探究活动:
可选用试剂:浓H2SO4、浓HNO3、10%盐酸、0.1mol/LH2SO4、0.1mol/L HNO3、0.1mol/LBaCl2、
11.(Ⅰ)下列实验操作或对实验事实的描述正确的是 (填序号);
① 实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉。
② 配制一定浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低。
③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末
④ 实验室用铜片与稀硝酸反应产生的气体可用排水法收集
⑤ 试管中加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现
⑥ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑦ 苯与溴水在铁粉的催化作用下制备溴苯
⑧ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
Ⅱ.在中学化学实验中,通常用无水硫酸铜来检验少量水的存在。由于无水硫酸铜吸湿性很强,需要现制现用。
方法甲:取2药匙细小的硫酸铜晶体置于_______中研碎后放入坩埚,将坩埚放在______上用小火慢慢加热并用玻璃棒不停搅拌,最后将坩埚移入___________中进行冷却(请选用合适仪器填空:表面皿、研钵、烧杯、通风橱、试管夹、干燥器、泥三角)。
方法乙:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20 mL浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5 min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干。
[交流与讨论]
(1)方法甲中,加热温度稍高时会出现变黑现象,原因是_________(用化学方程式表示)。
(2)方法乙中,浓硫酸的作用是__________;为了不浪费药品,对无水乙醇洗涤液进行再生的方法是______ ,所用的主要玻璃仪器有烧瓶、接液管、锥形瓶、酒精灯________________等。
(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想______________。
 (4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4•5H2O的新工艺。模拟制备装置如下图所示。
(4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4•5H2O的新工艺。模拟制备装置如下图所示。
[问题一]如图装置中,分液漏斗内装的液体是________,反应结束时,获取CuSO4•5H2O的操作过程是先________________,趁热将三颈瓶中的液体倒入烧杯中冷却,析出晶体CuSO4·5H2O ,过滤、晾干。
[问题二]工业上用石灰乳吸收尾气,除了防止环境污染外,还能得到了有经济实用价值的副产品-- 亚硝酸钙。尾气吸收生成亚硝酸钙的化学方程式是_______________。
10、茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、Al、Fe三种元素。
[查阅部分资料] 草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、Al3+、Fe3+完全沉淀的pH为Ca(OH)2:pH≥13;Al(OH)3:pH ≥5.5;Fe(OH)3:pH≥4.1。
铝试剂,分子式:C22H23N309,中文名玫红三羧酸三铵,用于测定水、食品等中的铝元素,铝离子与铝试剂生成玫瑰红物质。(铝试剂也能与铁离子形成红至紫色配合物。)
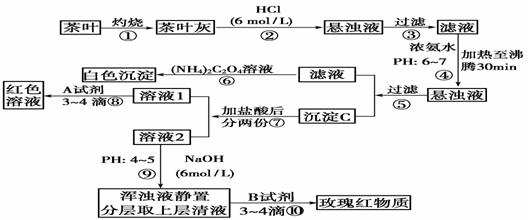
试根据上述过程及信息填空:
(1)上述实验方案中,检出钙元素的实验步骤是_______________,检出铁元素的实验步骤是___________,检出铝元素的实验步骤是_______________(填实验步骤编号)。
(2)步骤②加盐酸的作用是 。
步骤④用浓氨水调节pH后,加热至沸30min的作用是 。
(3)写出检验Ca2+的离子方程式 。
(4)写出沉淀C所含主要物质的化学式 。
(5)写出步骤⑧用A试剂生成红色溶液的离子方程式 。
(6)步骤⑨的作用是 ,
9.磁材氧化铁的化学名称是氧化铁(Fe2O3),它是电子、电信工业的磁性材料,工业上
采用生产钛白粉的下脚料(含大量FeSO4的废液)为原料来制备磁材氧化铁。

已知煅烧中的化学反应方程式为:FeCO3 = FeO + CO2↑,4FeO + O2 = 2Fe2O3
(1)用98%的H2SO4的配制500mL的20%的H2SO4,所需玻璃仪器是
A、玻璃棒 B、烧杯 C、漏斗 D、250mL容量瓶
E、500mL容量瓶 F、胶头滴管
(2)浓缩结晶后得到的晶体是 (填化学式),A中溶质是 ;
此溶液中各离子的浓度比较大小为: 。
(3)20%H2SO4和铁皮的作用分别是 。
(4)检验滤液中含有NH4+的方法是
。
(5)写出步骤“合成”中发生的化学变化(用化学方程式表示):
。
8.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一,对下列实验现象或实验操作的解释正确的是
|
|
现象或操作 |
解释 |
|
A |
将氯化铁固体溶入加有盐酸的水中配制氯化铁溶液 |
抑制Fe3+的水解 |
|
B |
某溶液中加入稀盐酸,放出无色无味气体,将气体通入澄清石灰水,石灰水变浑浊 |
该溶液中存在CO32- |
|
C |
溴水中加入甲苯,充分振荡后静置,溴水层褪色 |
甲苯与溴水发生了取代反应 |
|
D |
铝箔在酒精灯火焰上加热熔化但不滴落 |
氧化铝熔点高,兜住熔融的铝 |
7.下表所示,为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正
确的是
|
|
不纯物质 |
除杂试剂 |
分离方法 |
|
A |
苯(甲苯) |
KMnO4(酸化),NaOH溶液 |
分液 |
|
B |
NH4Cl溶液(FeCl3) |
NaOH溶液 |
过滤 |
|
C |
乙酸乙酯(乙酸) |
饱和Na2CO3溶液 |
分液 |
|
D |
苯(苯酚) |
浓Br2水 |
过滤 |
6. 下列实验装置设计正确,且能达到目的的是
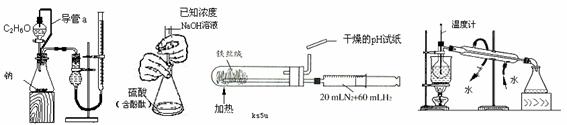
|
的物质的量的浓度 并回收CCl4
A B C D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com