
25、HOOC-COOH CO2↑+CO↑+H2O (2分)
CO2↑+CO↑+H2O (2分)
24、(1)增大O2浓度,提高SO2的利用率?(2分)
(2)反应速率大,催化剂活性最高,缩短反应达到平衡的时间(2分)
(3)常压(1分) 增大压强对设备及动力系统要求高,成本大,且在常压下,SO2的转化率已很高?(1分)
(4)减少环境污染,提高SO2的利用率(2分)
23、⑴溶液蓝色恰好褪去所需的时间,吸收前后颗粒吸附剂、盛放容器的总质量(2分)
⑵①800 (2分) ②抽气速度过快, (2分)
③将50mL5×10-4mol/L的碘溶液的体积减小为5mL,并将广口瓶改为试管(2分)
⑶④(1分)
22、 (1)3Fe + 4H2O(g) = Fe3O4 + 4H2 (2分)
(2)一定有Fe3O4,可能有Fe(2分) Fe3O4和Fe(2分)
(3)Fe + 2Fe3+ = 3Fe2+ (2分)
(4)FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4 (2分)
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 (2分)
(5)还原(1分) Fe2+ 易被空气中的氧气氧化而变质(2分) 铁粉(2分)
1、C 2A3A4A5B6A7B8D9A10B11A12C13B14D15A16D17A18A19C20A
21(1)FeS (1分) FeS2(1分)
(2)4FeS2+11O2 2Fe2O3+8SO2(2分)
2Fe2O3+8SO2(2分)
2H2S+SO2=2H2O+3S↓(2分)
6FeSO4+3Br2=2Fe2(SO4)3+2FeBr3(2分)
28、.某化工厂用接触法制硫酸时所用的黄铁矿含FeS278%。在煅烧黄铁矿制备SO2时损失6%的硫;SO2转化为SO3时,测得SO2的转化率为90%;吸收塔内SO3的吸收率为98%。生产500吨98%的浓硫酸,在理论上需要这种黄铁矿石多少吨?
27、一般测定样品中成分含量的实验应重复2-3次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙、丙三位同学分别设计了如下实验方案:

Ⅰ.甲同学的方案如上图所示:
(1)根据甲同学的实验装置图分析,在每次实验过程中所进行的称量操作至少要进行
次;用什么方法证明A装置不漏气? 。
(2)甲同学重复测定了三次,得到碳酸钠的质量分数的数据存在较大的偏差,你认为可能引起测量结果偏低的原因是 (填序号)。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收;
B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收;
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收;
D.加入稀硫酸的量不足
Ⅱ.乙同学的方案是:从下图所提供的装置中选择实验装置,代替甲同学实验的B、C,通过测定放出的二氧化碳的体积(不考虑二氧化碳溶于水)来计算。

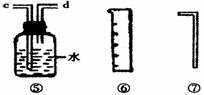
选择最简装置的连接顺序为 ;
Ⅲ.丙同学的方案是:称取样品m g,并溶解,加入过量氯化钡溶液,过滤、洗涤、烘干、称量,得固体n g。
(1)配制100 mL 0.10 mol·L-1 BaCl2溶液及过滤实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒外还有_______________________________(填仪器名称);
(2)混合物中碳酸钠的质量分数为(用m、n表示) 。
(3)Ca2+、Ba2+都可以使CO32-沉淀完全。能否使用氯化钙溶液代替氯化钡溶液?为什么?
26、某化学兴趣小组的同学买来一瓶“84”消毒液,请大家与他们一同来研讨以下问题:
(1)此瓶“84”消毒液的说明书上这样写道:“本品为无色液体,呈碱性……”,请你推测它的有效成分_______(填序号):A.Cl2 B.H2O2 C.NaClO D.KMnO4
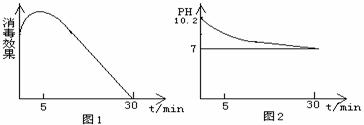
(2)该化学兴趣小组的同学在瓷碗中盛放20mL的“84”消毒液,露置在阳光充足的室内,他们对“84”消毒液的消毒效果和组成成分的变化进行了研究。得出数据如下:
从数据图1和图2可得知“84”消毒液暴露在空气中半小时后,“84”消毒液中的主要溶质是_____,用化学方程式或离子方程式表示其中变化的主要原因 、 、 。
(3)该化学兴趣小组的同学备选了紫色石蕊试液对“84”消毒液的性质进行实验检验请你帮助他们完成实验报告:
|
实验操作 |
预期现象 |
结论 |
|
|
|
|
(4)该化学实验小组同学上网查询有关“84”消毒液的信息时,发现这样一则消息:有一家庭主妇把抗SARS用的“84”消毒液和清洁济(呈酸性、含Cl-)都倒出一些混合在一起,进行刷洗。一会儿,她就晕倒在房间里。这几位同学感到迷惑不解。请你用离子方程式帮助他们解开这一悬念
25、乙二酸受热分解的化学方程式为 。
24、在硫酸工业中,通过下列反应使SO2转化为SO3:2SO2(g)+O2(g) 2SO3(g);ΔH=-196.6 kJ·mol-1。已知常压下平衡混合气体中SO3体积分数为91%,试回答下列问题:
(1)在生产中常用过量的空气是为了__________________________________________。
(2)加热到400-500 ℃是由于______________________________________________。
(3)压强采用__________,原因是_____________________________________________。
(4)尾气中的SO2必须回收,是为了_________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com