
14.W、X、Y、Z均为短周期主族元素,W的最外层电子数与核外电子总数之比为3:8;X的核外电子总数与Y的最外层电子数相等,X的原子序数是Z的原子序数的一半;W、Y、Z位于同一周期。
(1)W的单质是一种_________色晶体。
(2)W、Y、Z三种元素的气态氢化物稳定性由高到低的顺序是 (用化学式表示)。
(3)已知A、B、C、D四种物质存在如下反应关系:A + B → C + D
①若A是Y和Z常见价态的化合物,B是X的氢化物,D是Y的氢化物,反应过程中没有化合价变化,该反应的化学方程式是 。
②若A是Z的单质,B为红色固体,D为紫红色固体单质,高温下发生该反应,C的化学式是 。D与X元素最高价氧化物对应水化物的浓溶液反应,生成的气体会对大气造成污染。用烧碱溶液吸收该气体生成两种盐,其中一种盐可用作防腐剂,烧碱溶液吸收气体的离子方程式是 。
13.下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是第三周期半径最小的金属元素组成的单质,K是一种红棕色气体。

请填写下列空白:
(1)A的化学式为 ,I的原子结构示意图为 。
(2)在周期表中,组成单质G的元素在周期表中的位置是___________________________。
(3)写出反应⑦的化学方程式
当有0.3 mol电子转移时,生成G的物质的量为 。
(4)在反应②、③、⑥、⑨中,既属于化合反应又能属于非氧化还原反应的是____________(填写序号)。
(5)G在潮湿的空气中容易发生腐蚀,写出其发生腐蚀时正极上的电极反应式
___________________________________________。
(6)用惰性电极电解C的稀溶液时,阴极产生标况下的气体11.2L时,阳极产物的物质的量是________ ,阳极发生反应的电极反应式为_________________________________。
(7) 写出反应④的离子方程式是 ____________________________________________。
(8)将化合物D与KNO3、KOH混合,在高温条件下可制得一种“绿色”环保高效净水剂
K2FeO4(高铁酸钾),同时还生成KNO2和H2O。
该反应的化学方程式是 _____ __ 。
12.A物质的微粒是由四个原子构成的分子,其中共有22个电子,A可溶解在水中;由A分解所得B、C的物质的量之比为1:3,B、C为常见的气态单质;甲、乙为金属单质,常温下乙不能溶解在H的浓溶液中;G、I的溶液均呈碱性。一定条件下各物质间的转化关系如下:
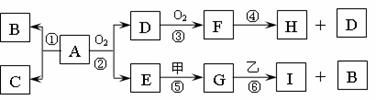
(1)单质C的电子式 。w.w.^w.k.s.5*
(2)A极不稳定,受撞击时立即发生分解反应且放出大量热而爆炸;A的水溶液呈弱酸性。
①从反应热的角度分析,通常状况下能否由B、C化合成A
;
②写出Zn与A的水溶液反应的化学方程式: 。
(3)反应④中每消耗1molF,转移电子的物质的量为 ;反应⑥的离子方程式是 。
11.A-I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
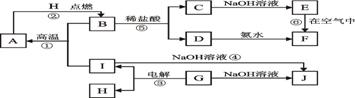
(1)A、B、C、D、E、F六种物质中所含同一种元素的名称为 ;
(2)若C→D为化合反应,则此时的化学方程式 ;
(3)写出反应④的离子方程式 ;
(4)写出反应③的电极方程式:阳极 ; 阴极 。
(5)从能量变化的角度看,①②③反应中属于△H>0的反应是_______。(填序号)
10.短周期元素A、B、C、D原子序数依次增大,A的单质是最轻的气体,A、C同主族,只有C是金属元素,B的最外层电子数是次外层电子数的3倍,B、C的最外层电子数之和与D的最外层电子数相等。
(1)C的原子结构示意图为 。
(2)化合物C2B2中阴阳离子个数比为 ,其中含有的化学键类型为 。
(3)化合物CDB是家用消毒剂的主要成分,其水溶液显碱性。请用离子方程式说明该化合物溶液呈碱性的原因是 。
(4)A单质、B单质和由A、B、C三种元素组成的化合物溶液可以设计成一种燃料电池,该电池负极的电极反应式为 。
(5)往CD溶液中滴加硝酸银溶液生成白色沉淀后,再滴加碘化钠,可观察到的现象是
。其反应的离子方程式为 。
9. X、Y、W、Q都是短周期元素,已知Y、X、W、Q的原子半径依次增大,X、Y同周期,X、W同主族,W原子核内的质子数等于X、Y原子核内的质子数之和,W原子最外层的电子数是Q原子最外层电子数的3倍。
(1)写出X、Y、W、Q所代表元素的符号。
X、 Y、 W、 Q
(2)W元素的单质有广泛用途,工业上制备该单质的化学方程式为:
(3)Y元素的某种单质通入酸性淀粉碘化钾溶液中,溶液变蓝,同时生成Y元素的另一种单质,该反应的离子方程式为:
(4)Y、W 、Q三种元素可组成一种盐,其溶液中各离子的浓度从大到小的顺序为:、
8. A、B、C、D、E、F为短周期六种元素,原子序数依次增大,其中A与E同主族且能形成离子化合物EA,B与F同主族,E与F同周期。D的核电荷数是B的最外层电子数2倍,单质F是一种重要的半导体材料。则下列推断中正确的是
A.由A、C、D三种元素组成的化合物不可能是离子化合物
B.F与D形成的化合物熔点高,可以与某种酸反应
C.原子半径由大到小的顺序是:E>F>C>D
D.五种元素中最高价氧化物对应的水化物酸性最强的是D
7.短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是
A.原子半径:A<B<C
B.A的氢化物稳定性大于C的氢化物稳定性
C.三种元素的最高价氧化物对应水化物均可由化合反应得到
D.高温下,A单质能置换出C单质
6.元素X、Y、Z原子序数之和为37,X、Y在同一周期,X+与Z-具有相同的核外电子层结
构。下列推测不正确的是
A.同周期元素中X的金属性最强 B.原子半径X>Y,离子半径X+>Z-
C.同族元素中Z的氢化物稳定性最高 D.同周期元素中Y的最高价含氧酸的酸性最强
5.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。则下列有关说法中正确的是
A.X的氢化物溶于水显酸性 B.Y的氧化物是离子化合物
C.Z的氧化物的水化物一定是强酸 D.X和Z的最高价氧化物对应的水化物都是弱酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com