
20.(每空3分,共18分)
 (1)NaCl
(2)原子
(3)Na+[ O H]- 碱性
(1)NaCl
(2)原子
(3)Na+[ O H]- 碱性
(4)3AlO2- + Al3+ + 6H2O = 4Al(OH)3↓ (5)14
19.(18分)该溶液中肯定存在的离子是 : I-、Ba2+、NH4+ (3分)
肯定不存在的离子是:Al3+、Fe3+、NO3-、CO32-、SO42-、MnO4- (6分)
还不能确定是否存在的离子是 :K+、Na+、Cl- (3分)
②请写出(2)(4)步骤中发生的离子方程式:
步骤(2) Cl2 + 2I- == 2Cl-+ I2 (3分)
步骤(4) Ba2+ + CO32- == BaCO3↓ (3分)
18.(每空3分,共6分)
⑴ P2O3 P2O5
⑵ P(s) + 3/4O2(g) == 1/2 P2O3(s);△H = -(20X-Y) KJ/mol
17.(每空2分,共10分)
⑴ A、悬浊液;B、溶液;C、胶体;
⑵ Fe3+ + 3SCN- = Fe(SCN)3;
⑶ FeCl3 + 3H2O  Fe(OH)3(胶体) + 3HCl
Fe(OH)3(胶体) + 3HCl
16.A
第Ⅱ卷 (非选择题共52分)
15. B解析:本题为计算题,可用守恒原理快速解决。由题意知:Mn+完全沉淀为碳酸盐,则溶液中剩余Na+与Cl-物质的量必然相等,即NaCl。15×2×2=40×0.5×n,求得n=3。当然,也可通过书写化学方程式,依据“物质的量之比等于系数比”及“原子守恒”观察得出。
B解析:本题为计算题,可用守恒原理快速解决。由题意知:Mn+完全沉淀为碳酸盐,则溶液中剩余Na+与Cl-物质的量必然相等,即NaCl。15×2×2=40×0.5×n,求得n=3。当然,也可通过书写化学方程式,依据“物质的量之比等于系数比”及“原子守恒”观察得出。
20.(18分)A、B、C、D是短周期元素所形成的单质,也是中学化学中常见的物质,通常情况下,A、B为固体,C、D为气体,电解H的水溶液生成X、C和D,此反应是一个重要的化工反应,这些物质间相互转化关系如下图所示。试回答:
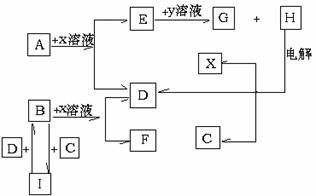 ⑴H的化学式为
;
⑴H的化学式为
;
⑵B单质为 晶体(填晶体类型)。
⑶X的电子式为 , F水溶液显性 (填:酸性、中性或碱性)。[来
⑷E和G化合物的水溶液混合发生反应,其离子方程式为:
⑸用惰性电极电解含0.2molH物质的水溶液,在阳极产生0.2mol气体时,此时溶液的体积为200ml。则溶液的pH= 。
19.(18分)有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Ba2+、Al3+、Fe3+、Cl-、I-、
NO3-、CO32-、SO42-、MnO4-,取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈强酸性。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色。
(3)另取出部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生。
(4)取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成。
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
①根据上述实验事实确定:
该溶液中肯定存在的离子是 ,
肯定不存在的离子是 ,
还不能确定是否存在的离子是
②请写出(2)(4)步骤中发生的离子方程式:
步骤(2)
步骤(4)
18.(6分)磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷(P)在3.2g的氧气中燃烧,至反应物耗尽,并放出X KJ热量
⑴通过计算确定反应产物的组成(用化学式表示)是 。
⑵已知单质磷的燃烧热为Y KJ/mol,则1mol P与O2反应生成固态P2O3的热化学反应方程式:
_ 。
17.(10分)A、B、C三只烧杯中,依次分别盛有NaOH溶液、KSCN溶液、煮沸的蒸馏水,各滴入FeCl3溶液,试根据实验现象分别回答以下问题:
⑴分别写出三只烧杯中形成分散系的名称:
A , B ,C 。
⑵写出B中形成分散系的离子方程式 。
⑶写出C中形成分散系的化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com