
2.定义:用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法叫酸碱中和滴定。
1.原理: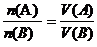 (A:酸,B:碱)
(A:酸,B:碱)
因为n=c·V
所以
cB=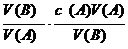
若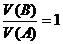 ,则c (B)=
,则c (B)=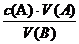
2.完成课本P75家庭小实验。
●板书设计
第四节 酸碱中和滴定
2.定义:用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法叫酸碱中和滴定。
[讲述]从原理来看,中和滴定很简单,但在实验中,要想尽可能地减小误差,获得较准确的测量结果,还必须使用精密的实验仪器和严格的实验操作,下面我们介绍一下中和滴定仪器的选择。
[板书]3.仪器的选择
[讲述]盛放标准液和量取待测液用到的精密仪器叫滴定管,滴定管有两种,盛放或量取酸液要用酸式滴定管,盛放和量取碱液用碱式滴定管。
[板书](1)滴定管(酸式、碱式)
[展示]酸式滴定管和碱式滴定管。
[师]请同学说出滴定管结构上有何特点,为什么酸式滴定管不能盛放碱液,碱式滴定管不能盛放酸液?读数时可以读到小数点后几位?
[学生分组观察滴定管后回答]
(1)零刻度在上方。
(2)酸式滴定管下端为玻璃活塞,盛放碱液会生成Na2SiO3,使活塞不能旋转。
(3)碱式滴定管下端为一段橡皮管,酸液会腐蚀橡胶。
(4)滴定管可以读到小数点后两位。
[展示]被腐蚀的酸式滴定管和碱式滴定管。
[师]这是两支被腐蚀的滴定管,已经都不能使用了,因此我们在以后的实验中一定要爱护仪器。
那么,我们用滴定管时,滴定管如何固定呢?
[生]铁架台和滴定管夹
[板书](2)铁架台、滴定管夹。
[展示铁架台和滴定管夹,并把滴定管固定在铁架台上]
[师]要计算待测液的浓度,还必须准确量取一定体积的待测液,那么用什么容器盛放待测液呢?
[生]甲:烧杯。乙:锥形瓶。
[讲述]在滴定过程中,为了使酸碱充分反应,要不断地摇动盛待测液的容器,因此,盛待测液的容器口径要小,以免摇动过程中液体溅出,因此选用锥形瓶。
[板书](3)锥形瓶。
[师]我们选好了仪器,但仍然不能得到准确的实验结果,因为我们无法知道加入的标准液是否已恰好和待测液完全中和,因此还要选择合适的指示剂,那么常用的指示剂有哪些?在不同的pH范围内各显什么颜色呢?请同学们打开书71页,看表3-2。
[讲述]石蕊也是一种指示剂,但由于其色差小,变色不敏锐,因此在滴定实验中一般不用。常用的指示剂为酚酞或甲基橙。
[板书](4)指示剂:酚酞或甲基橙。
[师]有了这些仪器和试剂我们就可以进行实验了,那么实验前需要做什么准备工作?实验中需要注意什么问题?实验后的数据如何处理?这些问题我们下一节课讨论。
[布置作业]1.课后作业一、二。
3.中和滴定的录像带、放像机、投影仪
●教学过程
★第一课时
[导入](教师举起一种食品包装袋,如奶粉的外包装袋)
[师]同学们在买到一袋食品时,注意到上面标有哪些说明吗?
[生]食用方法、成分、含量、生产日期等等。
[师]在这些说明中,成分及其含量的测定,都属于化学工作者的任务。在化学上,鉴定物质是由哪些成分组成的叫定性分析,而测定各成分的含量分别为多少叫定量分析。我们今天就学习一种定量分析方法。
[板书]第四节 酸碱中和滴定
[问]什么叫中和反应?
[生]酸和碱反应生成盐和水的反应叫中和反应。
[师]请同学们写出以下几个反应的方程式:①HCl+NaOH ②H2SO4+NaOH ③H3PO4+NaOH
[学生练习,并使一个学生板演]
HCl+NaOH====NaCl+H2O
H2SO4+2NaOH====Na2SO4+2H2O
H3PO4+3NaOH====Na3PO4+3H2O
[师]请同学们把以上化学方程式改写为离子方程式。
[教师提示]H3PO4是弱电解质,注意离子方程式中的写法。
[学生写完后,教师总结]由以上离子方程式我们可以看出,酸碱中和反应的实质,都是酸电离的H+和碱电离出的OH-反应生成H2O,那么中和滴定的原理是什么呢?
[板书]1.原理
[师]从酸碱反应的化学方程式来看,酸碱恰好完全反应时,其物质的量与化学计量数之间有何关系?
[生]酸碱物质的量之比等于化学计量数之比。
[师]如果我们用A表示酸、B表示碱,就有以下关系式:
[板书]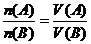 (A:酸;B:碱)
(A:酸;B:碱)
[讲述并板书]我们知道,在溶液中溶质的物质的量与溶液体积和浓度又有如下关系:
n=c·V
代入上式可得出: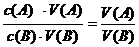
[讲述]根据以上关系式,用一种已知浓度的酸与一定体积的未知浓度的碱反应,若能测得恰好完全反应时消耗酸的体积,就可求出碱的浓度,这就是中和滴定的原理。即:
[板书]c(B)=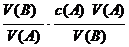
[讲述]若酸、碱都是一元的,则c(B)=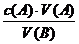
[板书]若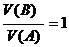 ,则c(B)=
,则c(B)=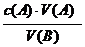
[师]下面我们利用以上关系式算一道题。
[投影]用0.1032 mol·L-1的HCl溶液,滴定25.00 mL 未知浓度的NaOH溶液,滴定完成时,用去HCl溶液27.84 mL。通过中和滴定测得NaOH 的物质的量浓度是多少?
[边分析边板书]根据NaOH和HCl反应的方程式,它们反应时物质的量之比为1∶1,由上述公式可求出NaOH的浓度。
解:因HCl和NaOH都是一元的,所以c(B)=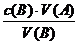
c(NaOH)=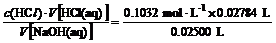 =0.1149 mol·L-1
=0.1149 mol·L-1
[师]请同学们根据以上原理,给中和滴定下个定义。
[学生叙述,教师板书]
2.25 mL的酸式滴定管、25 mL的碱式滴定管、锥形瓶、铁架台、滴定管夹、烧杯
1.盐酸标准液、未知浓度的NaOH、酚酞
4.激发学生的创造意识,培养学生分析问题、解决问题的能力。
●教学重点
酸碱中和滴定的原理
●教学难点
酸碱中和滴定的计算依据及有关计算
●课时安排
两课时
●教学方法
采用启发式教学。
●教学用具
3.使学生掌握有关酸碱中和滴定的简单计算。
2.使学生初步了解酸碱中和滴定的操作方法。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com