
28、 (5分)在一定条件下,可逆反应A + B
(5分)在一定条件下,可逆反应A + B
 mC.变化右图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC.变化右图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
(1)温度T1 T2(填大于、等于或小于)
(2)正反应是 反应(填“吸热”或“放热”)
(3)如果A、B、C均为气体,则m 2;(填大于、等于或小于)
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强 ---- (填增大、减小或不变),平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”)。
27、(5分)亚硝酸钠(NaNO2)又称工业盐,其外观类似食盐,但有剧毒。近年来,建筑工地多次发生民工误食工业盐而中毒的事件。利用如下反应可鉴别NaNO2和NaCl。
___KMnO4+___NaNO2+___H2SO4=___MnSO4+___K2SO4+___NaNO3+___H2O
(1)配平上述反应的化学方程式;(2分)
(2)指出该反应的氧化剂 ;(1分)
(3)当有2mol电子转移,则有 mol还原剂被氧化。(2分)
26.(6分)现有PH=12的NaOH溶液100ml,要使它的PH降为11。
(1)如果加入蒸馏水,应加 ml
(2)如果加入PH=10的NaOH溶液,应加 ml
(3)如果加入0.01mol/L的盐酸,应加入 ml
25.等物质的量浓度的下列五种溶液,1CH3COOH 2(NH4)2CO33NaHSO44NaHCO35Ba(OH)2,溶液中水的电离程度由大到小排列正确的是( )。
A.53142 B. 35124
C.24315 D. 24135
雅安中学09-10学年高二上学期九月月考
化 学 试 题
(考试时间90分钟,满分100分)
第Ⅱ卷(共50分)
24.室温时,某溶液中由水电离生成的H+和OH-物质的量浓度的乘积为10-24,则在该溶液中一定不能大量共存的离子组是( )。
A.Al3+、Na+、NO3-、Cl- B.K+、Na+、Cl-、CO32-
C.NH4+、Na+、Cl-、SO42- D.NH4+、K+、SiO32-、NO3-
23.常温下,某一元强酸HA和一元弱碱BOH的pH之和为14,有关这两种溶液混合的说法中不正确的是( )。
A.混合之前两种溶液中由水电离产生的c(H+)相同
B.若混合后恰好完全中和,反应液中水的电离程度比纯水中大
C.若混合后溶液呈中性(pH=7),则V(HA)> V(BOH)
D.等体积混合两种溶液,反应后因生成强酸弱碱盐而使溶液呈酸性
22.在Na2CO3溶液中,下列等量关系成立的是( )。
A. c(OH-)=c(HCO3-)+c(H2CO3)+c(H+)
B. 2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C. c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
D. c(Na+)+c(OH-)=2c(CO32-)+3c(HCO3-)+4c(H2CO3)+c(H+)
21、下图中a曲线表示一定条件下的可逆反应 X (g) + Y (g)  2Z (g) +
W(s),正反应放热的反应过程。若使a曲线变为b曲线,可采取的措施是
2Z (g) +
W(s),正反应放热的反应过程。若使a曲线变为b曲线,可采取的措施是
 A.增大压强 B.增大X的浓度
A.增大压强 B.增大X的浓度
C.升高温度 D.加入W
20、在2A+B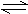 3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的是
3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的是
A.vA=0.5mol·L-1·min-1 B.vB=0.3mol·L-1·min-1
C.vC=0.8mol·L-1·min-1 D.vD=1mol·L-1·min-1
19、下列各图中能表示A(g)+B(g)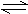 2C(g)(正反应为放热反应)这个可逆反应的为
2C(g)(正反应为放热反应)这个可逆反应的为


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com