
21.(14分)常温下Ca(OH)2的Ksp=5.5×10-6, KspAg2SO4= 1.2 ×10-5 KspAgCl=1.56×10-10 现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+ 阴离子有Cl-、OH-、HCO3-、NO3-、SO42-、CO32-,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:
阴离子有Cl-、OH-、HCO3-、NO3-、SO42-、CO32-,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:
① 测得溶液A、C、E呈碱性,且碱性为A>E>C;
② 向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
④在D溶液中滴加BaCl2溶液末看到白色沉淀
根据上述实验现象,回答下列问题:
(1)写出下列化合物的化学式:A C D E
(2)写出③中白色絮状沉淀变成红褐色过程中发生的化学反应方程式
(4)小骐同学欲将B、F混合,不小心将B、F倒入了稀盐酸中,马上看到有白色沉淀,你认为此白色沉淀中一定有 ,该同学还可以看到另一个现象,用离子方程式解释产生原因 。
19.下列是有关实验的叙述中,合理的是 ( )
①用pH试纸测得氯水的pH为2 ②不宜用瓷坩埚灼烧氢氧化钠固体
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤使用pH试纸测定溶液pH时先润湿,测得溶液的pH都偏小
⑥实验室配制氯化铁溶液时,可以先将氯化铁溶解在盐酸中,再配制到所需要的浓度
A.②④⑥ B.②③⑥ C.①②④ D.②③④⑤⑥
20现有CuO和Fe2O3组成的混合物a g,向其中加入2 mol·L-1的硫酸溶液50mL,恰好
完全反应。若将a g该混合物在足量H2中加热,使其充分反应,冷却后剩余固体质量
A)1.6 a g B)(a-1.6) g C)(a-3.2) g D)a g
II 非选择题
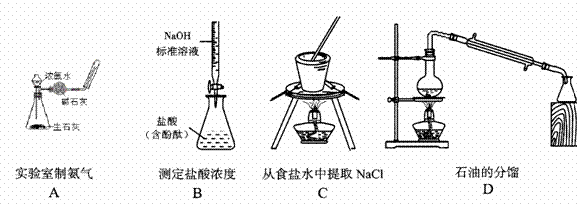
18.用下列实验装置进行的实验,能达到相应的实验目的的是 ( )
17.甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL 0.1 mol·L-1 AlCl3溶液,两烧杯中都有沉淀生成。下列判断正确的是
A.甲中沉淀一定比乙中的多 B.甲中沉淀可能比乙中的多
C.甲中沉淀一定比乙中的少 D.实验过程中甲中和乙中的现象始终保持一致
16. 胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法:①该化合物属于芳香烃;②分子中至少有7个碳原子处于同一平面;③它的部分同分异构体能发生银镜反应;④1mol该化合物最多可与2molBr2发生反应。其中正确的是
A.①③ B.①②④ C.②③④ D.②③
15.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A)25℃时,PH=13的1.0L Ba(OH)2溶液中含有的OH-离子数目为0.2NA
B)标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
C)室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
 D)标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA
D)标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA
14.下列实验操作或原理不正确的是
A. 除去氯化钠晶体中少量的硝酸钾

B. 纸层析法中的展开剂之所以能够展开的主要原理是毛细现象
C只用淀粉溶液即可检验加碘食盐中是否含碘酸盐,从碘水中提取单质碘时,不能用无水乙醇代替CCl4
D. 可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油
13.下列除杂质的方法不可行的是( )
A.用过量氨水除去Al3+溶液中的少量Fe3+
B.将混合气体通过灼热的铜网除去N2中的少量O2
C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D.用盐酸除去AgCl中少量的Ag2CO3
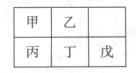
12.短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
A.原子半径: 丙<丁<戊 B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊 D.最外层电子数:甲>乙
11.在下列各溶液中,离子一定能大量共存的是
A)强碱性溶液中: K+、Al3+、Cl-、SO42-
B)在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,Na+、K+、Cl-、HCO3-
C)含有0.1 mol·L-1Ca2+溶液在中: Na+、K+、CO32-、Cl-
 D)室温下,pH=1的溶液中: Na+、Fe3+、NO3-、SO42-
D)室温下,pH=1的溶液中: Na+、Fe3+、NO3-、SO42-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com