
1924年,德布罗意(due de Broglie, 1892-1960)最早想到了这个问题,并且大胆地设想,对于光子的波粒二象性会不会也适用于实物粒子。
De . Broglie 1924年发表了题为“波和粒子”的论文,提出了物质波的概念。
他认为,“整个世纪以来(指19世纪)在光学中比起波动的研究方法来,如果说是过于忽视了粒子的研究方法的话,那末在实物的理论中,是否发生了相反的错误呢?是不是我们把粒子的图象想得太多,而过分忽略了波的图象呢”
于是,他提出:一切实物粒子都有具有波粒二象性。即每一个运动的粒子都与一个对应的波相联系。
能量为E、动量为p的粒子与频率为v、波长为l的波相联系,并遵从以下关系:E=mc2=hv
p=mv=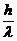 其中p:运动物体的动量 h:普朗克常量
其中p:运动物体的动量 h:普朗克常量
1、德布罗意波
这种和实物粒子相联系的波称为德布罗意波(物质波或概率波),其波长l称为德布罗意波长。
(1)、E=hν 光子说不否定波动性
光具有能量动量,表明光具有粒子性。光又具有波长、频率,表明光具有波动性。且由E=hν,光子说中E=hν,ν是表示波的物理量,可见光子说不否定波动说。
(2)、光子的动量和光子能量的比较:p=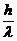 与ε=hν
与ε=hν
P与ε是描述粒子性的,λ、ν是描述波动性的,h则是连接粒子和波动的桥梁
波粒二象性对光子来讲是统一的。
23.(4).取1g含SiO2和FeS2的矿石样品,在氧气中充分燃烧,残余固体质量为0.84g。用这种矿石100t,可以制得98%的H2SO4多少吨?(设生产过程中硫损失2%)
莲塘一中2009-2010学年上学期高三年级第一次月考
22.(9分)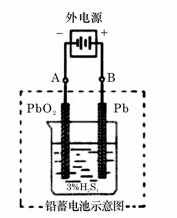
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO2-4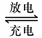 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1) 放电时:正极的电极反应式是______________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
(2) 在完全放电耗尽PbO2和Pb时,若按题右图连接,电解一段时间后,则在A电极上生成__________、B电极上生成________,此时铅蓄电池的正负极的极性将________________________。
21.(10分)已知:两个羟基同时连在同一碳原子上的结构是不稳定的,它将发生脱水反应:
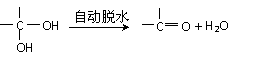
现有分子式为C9H8O2Br2的物质M,有机物C的相对分子质量为60,在一定条件下可发生下述一系列反应: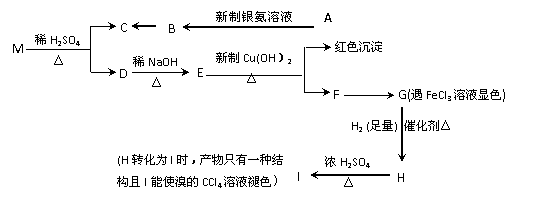
请回答下列问题:
⑴G→H的反应类型是 ______ 。
⑵C的结构简式为 __________ ;M的结构简式为 __________ 。
⑶写出下列反应的化学方程式:
①A→ B的化学方程式: _______ ;
②H→I的化学方程式: ___ 。
20、(8分)某强碱性溶液中可能含有的离子是K+、NH4+、Al 3+ 、AlO2-、SO42- 、SiO32- 、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是_______ ______,
肯定不存在的离子是_______ _________
(2)已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?_________________。
(3)按照反应顺序逐步书写出②中发生反应的离子反应方程式
① ②
③ ④
⑤
19.
 (10分)A、B、C、D、E、F均是元素周期表中按原子序数依次增大的前20号元素,其中只有A、D和B、E分别是同一主族元素,B、E两元素原子核中质子数之和是A、D两元素原子核中质子数之和的两倍,又知六种元素的单质中有三种气体、三种固体。部分元素在元素周期表中的相对位置关系如下:
(10分)A、B、C、D、E、F均是元素周期表中按原子序数依次增大的前20号元素,其中只有A、D和B、E分别是同一主族元素,B、E两元素原子核中质子数之和是A、D两元素原子核中质子数之和的两倍,又知六种元素的单质中有三种气体、三种固体。部分元素在元素周期表中的相对位置关系如下:
|
|
C |
|
E |
|
请回答:

 (1)D、E组成的常见的化合物,其水溶液呈碱性,原因是
(1)D、E组成的常见的化合物,其水溶液呈碱性,原因是


 (用离子方程式表示)。
(用离子方程式表示)。

 (2)E的单质能跟D的最高价氧化物对应水化物的热浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式
。
(2)E的单质能跟D的最高价氧化物对应水化物的热浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式
。

 (3)C、F所形成的化合物为离子化合物,其晶体结构模型如下:
(3)C、F所形成的化合物为离子化合物,其晶体结构模型如下:


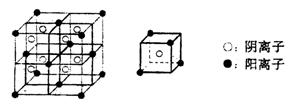













 该离子化合物的化学式为
。
该离子化合物的化学式为
。

 (4)4.0gE的单质在足量的B的单质中完全燃烧,放出37.0kJ热量,写出其热化学方程式:
(4)4.0gE的单质在足量的B的单质中完全燃烧,放出37.0kJ热量,写出其热化学方程式:

 。
。

 (5)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH浓溶液,两极均有特制的防止气体透过的隔膜,在A极通入A的单质,B极通入B的单质,则A极是该电池的 极;B极的电极反应式是
。
(5)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH浓溶液,两极均有特制的防止气体透过的隔膜,在A极通入A的单质,B极通入B的单质,则A极是该电池的 极;B极的电极反应式是
。
18.(7分)A、B、C三只烧杯中,依次分别盛有NaOH溶液、KSCN溶液、煮沸的蒸馏水,各滴入FeCl3溶液,试根据实验现象分别回答以下问题:⑴分别写出三只烧杯中形成分散系的名称:A
,
B
C
。
⑵写出A中形成分散系的离子方程式 。
⑶写出C中形成分散系的化学方程式
。
17.(4分)理论预测以下物质的物理性质,用>、=、<填空:
(1)CS2的沸点_________ CO2的沸点。 (2)CsCl的熔点_________KCl的熔点。
(3)金属K的硬度_________金属Ca的硬度 4)金刚石的硬度_________晶体硅的硬度。
16.“对氨基苯甲酸丁酯”是防晒霜中能吸收紫外线的防晒剂。下列关于“对氨基苯甲酸丁酯”的说法正确的是
A.它的分子式是C11H15NO2
B.从有机物分类看,它可属于“氨基酸类”、“酯类”、“芳香烃类”
C.它能与盐酸反应,但不能与苛性钠溶液反应
D.甲酸丁酯基(-COOC4H9)只有三种不同结构
第Ⅱ卷(非选择题,共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com