
2.实质:水的电离平衡正向移动。
CH3COONa====CH3COO-+Na+
+
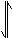
 H2O
H+
+OH-
H2O
H+
+OH-
CH3COOH
 即CH3COO-+H2O CH3COOH+OH-
即CH3COO-+H2O CH3COOH+OH-
1.定义:溶液中盐电离出的离子跟水电离出的H+或OH-结合,生成弱电解质的反应,叫盐类的水解。
3.NH4Cl溶液中,离子浓度由大到小顺序正确的是( )
A.c(NH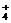 )>c (Cl-)>c (H+)>c (OH-)
)>c (Cl-)>c (H+)>c (OH-)
B. c (Cl-)>c (NH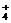 )>c (H+)>c (OH-)
)>c (H+)>c (OH-)
C. c (H+)>c (OH-)>c (NH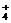 )>c (Cl-)
)>c (Cl-)
D. c (Cl-)>c (NH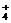 )>c (OH-)>c (H+)
)>c (OH-)>c (H+)
答案:1.BC 2.AB 3.B
[布置作业]教材P66一、1.2. 二 P67三
●板书设计
第三节 盐类的水解
2.某溶液由水电离出的H+浓度为10-13mol·L-1,则该溶液的pH可能是( )
A.13 B.1 C.6 D.7
1.盐类水解的过程中正确的说法是( )
A.盐的电离平衡破坏
B.水的电离平衡发生移动
C.溶液的pH发生改变
D.没有发生中和反应
[师]下面我们先分析一下CH3COONa溶液显碱性的原因。
任何一种盐都可以看作酸碱反应的产物,那么CH3COONa是由什么酸和碱反应生成的呢?
[生]CH3COOH和NaOH反应生成。
[师]CH3COOH是弱酸、NaOH是强碱,因此我们可以把它称为强碱弱酸盐。请同学们写出CH3COONa溶液中溶质和溶剂的电离情况。
 [指定学生板演]H2O H++OH-
[指定学生板演]H2O H++OH-
CH3COONa====CH3COO-+Na+
[讲述]从这两个电离方程式可看出,在CH3COONa溶液中,存在着H+、OH-、CH3COO-、Na+四种离子,由于NaOH是强电解质,在溶液中全部电离,所以溶液中的OH-与Na+不会结合,不影响水的电离,但CH3COOH是弱电解质,所以溶液中的CH3COO-和H+可结合成难电离的CH3COOH分子,消耗H+,破坏水的电离平衡,使水的电离平衡正向移动,那么CH3COO-与H+会不会无限减小,直至其中一种离子消耗完呢?
[生]不会。
[师]对,由于CH3COOH在生成的同时也要电离,且电离出的H+还可与溶液中的OH-结合生成比它更难电离的水,因此,这也是一个动态平衡,这种盐电离出的离子与H2O电离出的离子之间建立的平衡称为水解平衡。
[讲述并板书]CH3COONa====CH3COO-+Na+
+
 H2O
H+
+OH-
H2O
H+
+OH-
CH3COOH
即CH3COO-+H2O CH3COOH+OH-
[电脑展示]CH3COONa水解的微观过程。
[师]请同学们根据CH3COONa的水解过程给盐类水解下个定义。
[学生回答,教师板书]
1.定义:溶液中盐电离出的离子跟水电离出的H+或OH-结合生成弱电解质的反应,叫盐类的水解。
[师]盐类水解过程中,水的电离程度有何变化?
[生]增大。
[师]可见盐类水解的实质是破坏水的电离平衡,使水的电离平衡正向移动的过程。
[板书]2.实质:水的电离平衡正向移动。
[师]下面请同学们自己分析一下NH4Cl为什么显酸性?
[生]NH4Cl电离出的NH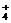 与水电离出的OH-结合,生成NH3·H2O,水的电离平衡正向移动,结果使溶液中H+浓度大于OH-浓度。
与水电离出的OH-结合,生成NH3·H2O,水的电离平衡正向移动,结果使溶液中H+浓度大于OH-浓度。
[师]请同学们用离子方程式表示一下NH4Cl的水解过程。
 [学生板演]NH
[学生板演]NH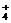 +H2O NH3·H2O+H+
+H2O NH3·H2O+H+
[师]请同学们再分析一下,为什么NaCl溶液是中性的?
[生]NaCl电离出的Na+和Cl-不能结合水电离出的OH-及H+,水的电离平衡不被破坏,因此H+和OH-浓度仍相同。
[问题探究]盐类能否水解与水解后溶液显什么性,同学们能找出有什么规律吗?
[生甲]跟生成这种盐的酸和碱的相对强弱密切的关系
[生乙]强酸和强碱生成的盐不水解,强酸和弱碱生成的盐水解显酸性,强碱和弱酸生成的盐水解显碱性。
[师]我们可以把盐类水解的规律简单归纳如下:
[板书]3. 规律:有弱才水解,无弱不水解,谁弱谁水解,谁强显谁性。
[师]请同学们根据水解规律,判断一下Na2CO3、Al2(SO4)3、KNO3三种盐溶液的酸碱性。
[生]Na2CO3溶液水解显碱性,Al2(SO4)3溶液水解显酸性,KNO3溶液不水解,显中性。
[师]那么大家的判断是否正确呢?请同学们用pH试纸测一下三种溶液的pH。
[学生实验验证]Na2CO3溶液pH>7,Al2(SO4)3溶液pH<7,KNO3溶液pH=7。
[讲述]Na2CO3与CH3COONa虽然水解都显碱性,但水解离子方程式写法不太相同,由于H2CO3是二元弱酸,所以CO 水解是分步进行的,第一步CO
水解是分步进行的,第一步CO 与H+结合生成HCO
与H+结合生成HCO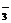 ,然后HCO
,然后HCO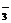 再与H+结合生成H2CO3分子,即:
再与H+结合生成H2CO3分子,即:
 [副板书]第一步:CO
[副板书]第一步:CO +H2O HCO
+H2O HCO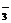 +OH-
+OH-
 第二步:HCO
第二步:HCO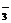 +H2O H2CO3+OH-
+H2O H2CO3+OH-
[师]请同学们自己练习一下Na2S、K3PO4溶液中水解方程式的写法。
[学生练习,教师巡视]
 [答案]S2-+H2O HS-+OH-
[答案]S2-+H2O HS-+OH-
 HS-+H2O H2S+OH-
HS-+H2O H2S+OH-
 PO
PO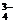 +H2O HPO
+H2O HPO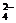 +OH-
+OH-
 HPO
HPO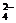 +H2O H2PO
+H2O H2PO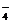 +OH-
+OH-
 H2PO
H2PO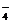 +H2O H3PO4+OH-
+H2O H3PO4+OH-
[讲述]对于多元弱碱的水解也是分步进行的,但水解方程式一般不分步写,如Al2(SO4)3的水解离子方程式为:
 [副板书]Al3++3H2O
Al(OH)3+3H+
[副板书]Al3++3H2O
Al(OH)3+3H+
[说明]无论是强碱弱酸盐还是强酸弱碱盐,一般条件下,其水解程度都是很小的,因此生成的酸或碱分子浓度都很小,所以生成的Al(OH)3不会沉淀析出。H2CO3也不会分解成CO2和H2O,在离子方程式中,不能写“↓”或“↑”符号。
我们只总结了强酸强碱盐和强酸弱碱盐、强碱弱酸盐的水解情况,那么弱酸弱碱盐是否水解呢?
[生]水解。
[师]对,弱酸弱碱盐不仅能水解,其水解程度还大于强酸弱碱盐和强碱弱酸盐,但其水溶液到底显酸性还是显碱性,取决于生成的弱酸和弱碱的相对强弱。有兴趣的同学课后可自己翻阅有关资料。
下面请同学们做以下的练习题。
[投影练习]
3.
2.
[问]怎么理解“摩尔”?
物质量的单位--国际单位制中的基本单位之一
1971年第14届国际计量大会决定,把0.012克C12所含的结构粒子数定义为1摩尔。
即:NA=6.02×1023mol-1
单位:个/摩尔--类似箱、打、年、光年等单位量
摩尔有两个含义:①能表示一种(特定)物质的质量
②能表示所含的结构粒子数
它是一个很大的数,但用在微观上,并不一定表示很多的量(如体积、质量等)
因为分子很小,所以构成一般(宏观上能测量到的)物体,需要很大的数目,NA就是起这样作用的一个单位量。
这是一个极其重要的物理量,它时宏观量和微观量之间的联系桥梁:
例:已知1摩尔的水质量0.018千克,求水分子质量
m=0.018千克/NA=3.0×10-26千克
微观的极小量构成了宏观,宏观的测量证实了微观(辩证关系)
无法直接测得的分子大小、分子质量跟宏观的摩尔体积、摩尔质量联系在一起。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com