
2.生物上经常提到缓冲溶液,向缓冲溶液中加少量酸或少量碱,pH几乎不变。举例说明生物上常见的缓冲溶液加酸或加碱时pH几乎不变的原因。
答案:常见的缓冲溶液:①Na2CO3与NaHCO3 ②NaH2PO4与Na2HPO4 ③NH4Cl与NH3·H2O等。
 以NH4Cl与NH3·H2O为例说明:在NH4Cl与NH3·H2O的混合溶液中,NH4Cl====NH
以NH4Cl与NH3·H2O为例说明:在NH4Cl与NH3·H2O的混合溶液中,NH4Cl====NH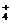 +Cl-,NH3·H2O NH
+Cl-,NH3·H2O NH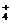 +OH-,加酸时NH3·H2O电离出的OH-中和了加进去的H+,使NH3·H2O电离平衡正向移动,溶液pH几乎不变。加碱时,溶液中的NH
+OH-,加酸时NH3·H2O电离出的OH-中和了加进去的H+,使NH3·H2O电离平衡正向移动,溶液pH几乎不变。加碱时,溶液中的NH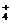 与OH-结合,生成NH3·H2O,使溶液pH几乎不变。
与OH-结合,生成NH3·H2O,使溶液pH几乎不变。
[布置作业]课本习题二 三、2
●板书设计
2.pH=10的NaOH加水稀释至原来的100倍,求稀释后溶液的pH。
答案:1.pH=3 2.pH=8
[师]如将pH为5的HCl溶液稀释1000倍,溶液的pH为多少?
[生甲]pH=8
[生乙]pH接近于7但比7小。
[师]酸稀释后可能变成碱吗?
[生]不能。
[师]所以甲的回答是错误的。
[讲述]在上述的几道题中,实际上我们都忽略了水的电离。但当溶液很稀,由溶质电离出的H+或OH-浓度接近10-7 mol·L-1时,水的电离是不能忽略的,忽略水的电离,会引起很大误差。下面我们共同计算pH=5的HCl溶液稀释1000倍后的pH.
[副板书]
解:设pH=5的HCl取1体积,水取999体积。
则稀释后:c(H+)=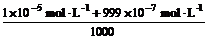 ≈1.1×10-7mol·L-1
≈1.1×10-7mol·L-1
pH=7-lg1.1<7
[师]同学们从以上的几道例题可以找出溶液稀释时pH的计算规律吗?
[学生讨论后回答,教师总结并板书]
a.pH=n的强酸稀释10m倍,稀释后pH=n+m;
b.pH=n的强碱稀释10m倍,稀释后pH=n-m;
c.若按上述公式算出的pH改变了溶液本身的性质,则稀释后pH一定接近7,酸略小于7,碱略大于7。
[师]下面我们再讨论溶液混合时pH的计算方法。
[板书]②溶液混合后pH的计算
[投影]1.将pH=8和pH=10的两种NaOH溶液等体积混合后,溶液中c(H+)最接近( )
A.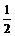 ×(10-8+10-10) mol·L-1
×(10-8+10-10) mol·L-1
B.(10-8+10-10) mol·L-1
C.(1×10-4+5×10-10) mol·L-1
D.2×10-10 mol·L-1
[分析]两种性质相同的溶液混合后,所得溶液的浓度可根据溶质和溶液体积分别相加后,再重新求解,要求碱溶液的pH,必须先求混合液OH-浓度。
[副板书]解:因为pH=8,所以c(H+)=10-8 mol·L-1
则c(OH-)= =10-6 mol·L-1
=10-6 mol·L-1
又因为pH=10,所以c(H+)=10-10 mol·L-1
则c(OH-)=
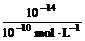 =10-4 mol·L-1
=10-4 mol·L-1
等体积混合后:
c(OH-)=
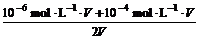 ≈
≈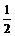 ×10-4 mol·L-1
×10-4 mol·L-1
所以c(H+)=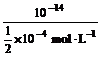 =2×10-10 mol·L-1
=2×10-10 mol·L-1
所以答案为D。
[投影]2.常温下,pH=4的HCl和pH=10的NaOH等体积混合,求混合液的pH。
[启发学生思考]酸的c(H+)和碱的c(OH-)分别为多少?盐酸和NaOH以等物质的量反应后生成什么?
[结论]混合液pH=7。
[师]请同学们讨论一下pH=5的盐酸和pH=10的NaOH等体积混合溶液显什么性?
pH=3的盐酸与pH=10的NaOH等体积混合后溶液显什么性?你从中可找到什么规律?
[学生讨论后回答,教师总结并板书]
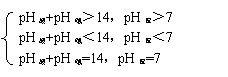
强酸和强碱等体积混合
[讲述]我们这节课主要学习了pH的计算方法,从pH的取值范围我们可以看出,当H+或OH-浓度大于1 mol·L-1时,用pH表示溶液酸碱性并不简便,此时pH会出现负值,因此,对于c(H+)或c(OH-)大于1 mol·L-1的溶液,直接用H+或OH-浓度来表示溶液的酸碱性。
我们这节课学习的溶液的pH与生产、生活有着密切的联系,是综合科目考试的热点,下面请同学们讨论以下两题:
 [投影]1.人体血液的pH保持在7.35~7.45,适量的CO2可维持这个pH变化范围,可用以下化学方程式表示:H2O+CO2
H2CO3
H++HCO
[投影]1.人体血液的pH保持在7.35~7.45,适量的CO2可维持这个pH变化范围,可用以下化学方程式表示:H2O+CO2
H2CO3
H++HCO 。又知人体呼出的气体中CO2体积分数约5%。下列说法正确的是( )
。又知人体呼出的气体中CO2体积分数约5%。下列说法正确的是( )
A.太快而且太深的呼吸可以导致碱中毒。(pH过高)
B.太快而且太深的呼吸可导致酸中毒。(pH过低)
C.太浅的呼吸可导致酸中毒。(pH过低)
D.太浅的呼吸可导致碱中毒。(pH过高)
答案:AC
1.常温下,将0.05 mL 1 mol·L-1的盐酸滴加到50 mL纯水中,求此溶液的pH。
2.求0.5 mol·L-1的Ba(OH)2溶液的H+浓度及pH
[指定两个学生板演]
答案:1.pH=1 2.c(H+)= =10-14(mol·L-1),pH=14
=10-14(mol·L-1),pH=14
[师]如果我们已知某溶液的pH,怎样求该溶液的H+或OH-浓度呢?下面我们看一道题。
[投影][例]:计算pH=2的H2SO4溶液中浓度及溶液中OH-浓度。
[问]根据pH的计算公式,可推出由pH计算溶液H+浓度的公式吗?
[学生回答教师板书]c(H+)=10-pH
[师]下面我们来算一下这道题。
[副板书]解:c(H+)=10-2mol·L-1
[以下师生边分析边板书]
因为1
mol H2SO4电离出2 mol H+,所以c(H2SO4)=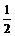 c(H+)=0.5×10-2mol·L-1=5×10-3mol·L-1
c(H+)=0.5×10-2mol·L-1=5×10-3mol·L-1
因为c(OH-)=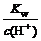 ,所以c(OH-)=
,所以c(OH-)=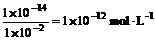
[师]请同学们自己完成以下练习:
[投影]求pH=9的NaOH溶液中的c(OH-)及由水电离出的c(OH-)水。
答案c(OH-)=10-5 mol·L-1 c(OH-)水=10-9 mol·L-1
[问题探究]已知100℃时,纯水的离子积为1×10-12,此时纯水的pH等于多少?呈酸性吗?为什么?
[学生讨论得出答案]此时纯水中的但并不呈酸性,而是中性,。因为此时水中的c(H+)=c(OH-)=10-6 mol·L-1,和H+和OH-的浓度相等,所以水仍是中性的
[师]那么请同学们计算一下,100℃时,pH=7的溶液是酸性还是碱性的?
[生]因为100℃时,pH=6的溶液是中性的,pH>6的溶液中, c(OH-)> c(OH+),因而pH=7的溶液是碱性的.
[总结]从这个问题我们可以看出,只有在常温下,才能说pH=7的溶液显中性,温度改变时,中性溶液的pH可能大于7,也可能小于7。
[师]下面我们看一看溶液在稀释时pH有何变化。
[板书]①溶液稀释后pH的计算
[投影]1.常温下,取0.1 mL 0.5 mol·L-1的硫酸,稀释成100 mL的溶液,求稀释后溶液的pH。
[师]请同学们先求一下稀释前溶液的pH。
[学生计算后回答]pH=0。
[师]稀释后H+的物质的量是否改变?
[生]不变。
[师]请同学们算一下稀释后溶液的pH。
[一个学生板演]
c(H+)=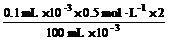 =1×10-3 mol·L-1
=1×10-3 mol·L-1
pH=-lg1×10-3=3
[师]碱稀释后如何求溶液的pH呢?下面我们再做一道题。
[投影]2.pH=13的NaOH溶液稀释1000倍,求稀释后溶液的pH。
[师]pH=13的NaOH溶液中c(H+)和c(OH-)分别为多少?
[生]c(H+)为10-13 mol·L-1,c(OH-)为10-1 mol·L-1。
[师]NaOH溶液中的H+来源于什么?OH-主要来源于什么?
[生]H+来自水的电离,而OH-主要来自NaOH的电离。
[讲述]NaOH溶液稀释时,由于水的电离平衡发生移动,所以溶液中H+的物质的量也有很大变化,但由NaOH电离出的OH-的物质的量是不变的,所以稀释时溶液中OH-的物质的量几乎不变(由水电离出的OH-可忽略不计)。在计算碱溶液稀释后的pH时,必须先求出稀释后溶液中的OH-浓度,再求出H+,然后再求溶液的pH。下面我们做一下第2题。
[以下边分析边板书]
解:pH=13的NaOH溶液中c(OH-)= =10-1 mol·L-1,稀释1000倍后,c(OH-)=
=10-1 mol·L-1,稀释1000倍后,c(OH-)=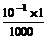 =10-4 mol·L-1,所以c(H+)=
=10-4 mol·L-1,所以c(H+)= =10-10mol·L-1
=10-10mol·L-1
pH=-lg10-10=10
[投影练习]
(一)气体的状态参量--体积、温度和压强
1、气体的体积:
国际单位制中,体积单位:m3
常用单位及换算关系:

2、气体的温度:
(1)温度:表示物体的冷热程度,是七个基本物理量之一。
(2)国际单位制中,用热力学温度标表示的温度,叫热力学温度。单位:开尔文。(符号):K
热力学温度摄氏温标换算关系:

3、气体的压强:
(1)气体压强:气体对容器壁单位面积上的压力。
(2)气体压强可以用压强计测量。
(3)压强的单位:
国际单位制中用:帕斯卡、符号:Pa 1 Pa = 1N / m2
常用单位:标准大气压 (atm)毫米汞柱(mmHg)
换算关系:1 atm = 760mmHg = 1.013×105 Pa
1mmHg
=  atm = 133.3 Pa
atm = 133.3 Pa
(2)气体的实验定律:
1、破意定律:
(1)定律:一定质量的气体在温度不变的条件下,它的压强跟体积成反比。
即: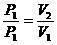
或: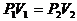
(2)适用条件:
①气体压强不太大(与大气压相比)
②温度不太低(与室温相比)
③质量不变,温度不变
(3)等温线:
①在P-V;P-T;V-T坐标中的等温线:
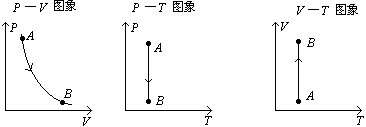
② 图象:
图象:
为一条过原点的直线: 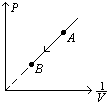
③对一定质量的气体,温度越高,PV越大(∵ PV=nRT)。下图为一定质量气体在不同温度下的等温线,其中
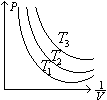
2、查理定律
(1)表述一:一定质量的气体,在体积不变的条件下,温度每升高(或降低)1℃,它们的压强增加(或减少)量等于在0℃时压强的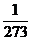
即: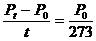
或 
P-t图中的等容线:过-273℃

(2)表述二:一定质量的气体,在体积不变的条件下,它的压强和热力学温度成正比。
即: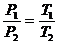
在P-V坐标中

(3)等容线
①

②一定质量在不同体积下的P-T图线(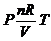 )
)
V越大,斜率(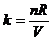 )越小。图中
)越小。图中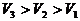
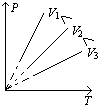
3、盖吕萨克定律:
(1)表述一:一定质量的气体,在压强不变的条件下,温度每升高(或降低)1℃,它的体积的增加(或减少)量等于0℃时体积的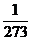 。
。
即: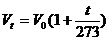
V-t坐标中等压线:

(2)表述二:一定质量的气体,在压强不变的条件下,它的体积跟热力学温度成正比。
即: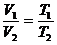
(3)等压线:
①

②一定量气体在不同压强下的V-T图象。(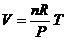 )
)
P越大,斜率( )越小。下图中
)越小。下图中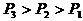
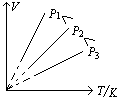
4、理想气体状态方程:
利用玻意耳定律和查理定律证明一定质量不理想气体满足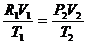
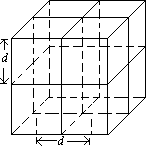
气体分子模型:
气体分子间距离比分子的线度大的多,在进行估算时,可以认为气体分子均匀分布在空间。每个分子占有一个小立方体的空间,分子位于重点方体中心,如图所示。
每个分子平均占空体积
分子间距离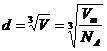
例:某容器中气体压强为0.2atm,温度为27°,求容器中空气分子间的平均距离。
解:1 mol 标况下的气体,在题目所给状态下,求占有的体积V,


每个分子平均占空体积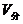
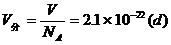
分子间的平均距离

气体的性质
知识要点:
2、估算液体或固体分子的直径:
估算液体或固体的分子直径时,可忽略分子之间的空隙,分子一个挨一个排列,则分子体积V分
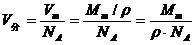
再将分子视为直径为d的小球
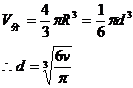
例1:已知铜的摩尔质量是64g / mol,铜的密度是8.9×103kg / m3试估算铜原子的质量和半径。
解:铜原子的质量
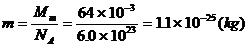
铜的摩尔体积:
铜的原子体积: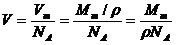
每个铜分子的直径:d
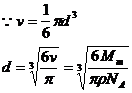
代入数据
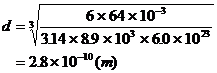
1、估算分子质量:
分子质量m,摩尔质量M摩。阿伏加德罗常数NA。
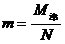
3、分子个数
解: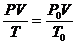
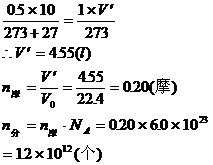
1、将所给气体状态转化为标准状态下,求出气体体积V′
2、用标况下气体的摩尔体积求出摩尔数n
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com