
1.去年的北京奥运会开幕式展示了中国辉煌灿烂的历史文化,让人浮想联翩。下列联想中正确的是:

A.左图展现的是隋唐时期的活字印刷术
B.东汉宦官蔡伦废物利用,发明了造纸术
C.“画中有诗”是诸多中国画杰作的共同特点
D.唐宋以来,浙江的景德镇窑、龙泉窑等瓷窑闻名天下
22.(11分)我国规定居室空气中甲醛的最高容许浓度为0.08mg·m-3。某研究性学习小组测定了一装修完工7天后的新居空气中甲醛的含量,方法如下:
①取空气样品250.0L,缓缓通入25.00mL 1.00×10-3mol/L的KMnO4溶液(加入3滴
6 mol/LH2SO4溶液),使其充分反应。离子方程式为:
4MnO4-+5HCHO+12H+ = 4Mn2++5CO2↑+11H2O
②过量的KMnO4溶液用2.00×10-3mol·L-1的草酸(H2C2O4)溶液滴定,到溶液刚好恰好反应为止,记录消耗草酸溶液体积的初读数和终读数。
③重复滴定3次。
数据记录:
|
滴定次数 实验数据 |
1 |
2 |
3 |
|
V(草酸)初读数/ml |
0.00 |
0.21 |
0.10 |
|
V(草酸)终读数/ml |
26.35 |
26.47 |
26.34 |
根据上述实验回答下列问题:
⑴欲配制500mL上述草酸溶液,需准确称取草酸晶体(H2C2O4·2H2O) g。(保留3位有效数字)
需要这么多的草酸晶体选择的仪器最好是
A、托盘天平(带砝码) B、酸式滴定管 C、电子天平
⑵第②步中过量的KMnO4溶液用草酸溶液滴定时,消耗草酸溶液体积的平均值为 mL。
发生的离子方程式为:2MnO4-+5H2C2O4+6H+= 2Mn2++10CO2↑+8H2O
本实验是否需要指示剂? (填是或否)。(若需要请指出指示剂的名称,若不需要,试说明如何确定滴定的终点。) 。
⑶试计算该新居中甲醛含量是 (单位:mg·m-3)。
⑷误差分析:
①如果第①步中通入空气样品速度过快,会使得甲醛含量的测定值 (填“偏高” 或“偏低”或“无影响”,下同。)
②配制标准草酸溶液定容时,仰视容量瓶,会使得甲醛含量的测定值 。
2009学年第一学期十校联合体高三期初联考
21. (12分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g)
Si3N4(s)+ 6CO(g)
(12分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g)
Si3N4(s)+ 6CO(g)
(1)该反应的氧化剂是 ;氮化硅熔点很高、硬度很大,属 晶体;
(2)该反应的平衡常数表达式为K= ;
(3)若知上述反应为放热反应,则其反应热△H 0(填“>”、“<”或“=”);降低温度,其平衡常数值 (填“增大”、“减小”或“不变”);
 若已知CO生成速率为v(CO)=15mol·L-1·min-1,
若已知CO生成速率为v(CO)=15mol·L-1·min-1,
则N2消耗速率为v(N2)= 。
(4)达到平衡后,改变某一外界条件(不改变
N2、CO的量),反应速率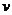 与时间t的关系如右图。
与时间t的关系如右图。
图中t4时引起平衡移动的条件可能是 ;
图中表示平衡混合物中CO的含量最高的一段时间
是 。
(5)在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,若N2的转化率为50%,则此温度下该反应的平衡常数为 K= 。
20.(15分)目前世界各国在抗击甲型H1N1流感,达菲(Tamiflu)被世界卫生组织推荐作为治疗和预防甲型H1N1流感的有效药物之一,它是由我国特有中药材八角的提取物--莽草酸(shikimicacid)为原料经过十多步反应合成的。已知莽草酸和达菲的结构式如下:
请完成:
(1)写出莽草酸分子式 ;
(2)写出莽草酸分子中官能团名称 ;
(3)达菲可能发生的反应类型有
A. 氧化反应 B. 水解反应 C. 加成反应 D. 消去反应
(4)1mol莽草酸最多能与 mol金属钠反应,最多可与 mol碳酸氢钠溶液反应。
(5)请写出莽草酸与乙醇在浓硫酸作用下酯化反应的化学方程式(有机物用结构简式表示):
;
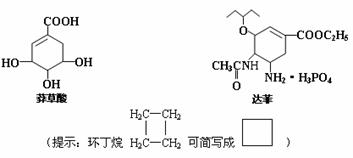
(6)莽草酸通过消去反应可以得到B(B的结构简式为: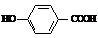 ),B在浓硫酸加热作用下可得到缩聚物C,C的结构简式是
;水杨酸是一种与B具有相同官能团的同分异构体,请写出水杨酸与乙酸酐合成阿司匹林(乙酰水杨酸)的化学方程式(有机物用结构简式表示):
;
),B在浓硫酸加热作用下可得到缩聚物C,C的结构简式是
;水杨酸是一种与B具有相同官能团的同分异构体,请写出水杨酸与乙酸酐合成阿司匹林(乙酰水杨酸)的化学方程式(有机物用结构简式表示):
;
B的同分异构体中既含有酚羟基又含有酯基的共有3种,写出其中一种同分异构体的结构简式 ;
19.(8分)右图A、B、C、D、E、F都是中学化学教材中常见的物质。反应①②③均在高温下进行。A在常温下为液态,C为黑色固体且有磁性,E、F既能溶于NaOH溶液又能溶于HCl溶液。完成:
(1)E中元素位于元素周期表中第 周期第 族。
(2)A的电子式为 ,A分子中原子间的键属于 键(填极性或非极性)
(3)反应①的化学方程式为: ;
反应③的化学方程式为: 。
(4)E溶于NaOH溶液的离子方程式为 ;
F溶于NaOH溶液的离子方程式为 ;
18.水热法制备Fe3O4纳米颗粒的反应为3Fe2+ + 2S2O +
O2 + xOH-
+
O2 + xOH- Fe3O4+S4O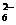 +2H2O,下列说法中,不正确的是( )
+2H2O,下列说法中,不正确的是( )
A.每生成1mol Fe3O4,反应转移的电子总数为4mol
B.Fe2+和S2O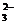 都是还原剂
都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
D.x=4
17.A、B、C、D、E是短周期五种元素,其原子序数逐渐增大。其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是次外层的3倍,C、D的核外电子数之和与B、E核外电子数之和相等。下列说法正确的是( )
A.原子电子层数:A<B B.气态氢化物的稳定性:B<E
C.简单离子半径:E<D D.最高价氧化物对应的水化物碱性:C<D
16.以下物质间的每步转化,存在不能通过一步反应实现的是( )
A.S→SO2→H2SO4→MgSO4 B.Fe→FeCl2→Fe(OH)2→Fe(OH)3
C.Al→Al2O3→Al(OH)3→NaAlO2 D.N2→NO→NO2→HNO3
15.下列根据实验现象所得出的结论一定正确的是( )
A.某无色溶液滴加酚酞试液后显红色,结论:溶液显碱性
B.某无色溶液加入盐酸产生无色无味气体,结论:溶液中一定含有CO32-
C.某气体能使品红溶液褪色,结论:该气体为SO2气体
D.电解某无色液体得到H2和O2,测其体积比为2:1,结论:此液体为纯水
14.下列反应中调节反应物用量或浓度,反应产物不会改变的是( )
A.碳在氧气中燃烧 B.二氧化硫通入石灰水中
C.硫酸加入锌粉 D.铁在氯气中燃烧
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com