
1、交变电流: 和 都随时间做 的电流叫做交变电流,电压和电流随时间按 变化的交流电叫正弦交变电流。
26.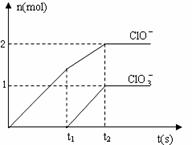 (分)在一定量的石灰乳中通入一定量的氯气,
(分)在一定量的石灰乳中通入一定量的氯气,
二者恰好完全反应(发生的反应均为放热反应)。生成物中
含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、
C1O3-两种离子的物质的量(n)与反应时间(t)的曲
线如右图所示。
(1)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为
__________________________________________。
(2)该石灰乳中含有Ca(OH)2的物质的量是___________________ mol。
(3)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入氯气的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后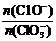 2(填“>”、“<”或“=”);
2(填“>”、“<”或“=”);
若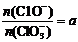 ,则n(C1-)= mol(用含a的代数式来表示)。
,则n(C1-)= mol(用含a的代数式来表示)。
25.(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示 ,K值大小与温度的关系是:升高温度,K值 。(填“一定增大”、“一定减小”或“可能增大也可能减小”)
(2)在一固定体积的密闭容器中,充入2molCO2和1molH2发生下列化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
|
T/℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
根据上表判断该反应是 反应。(填“吸热”或“放热”)
(3)在一体积为10 L的密闭容器中,加入一定量的CO2和H2(g),在1173K时发生反应并记录反应前5min的浓度,第6min时改变了反应的条件,引起浓度的变化。各物质的浓度变化(mol/L)见下表:
|
时间/min |
CO2 |
H2 |
CO |
H2O |
|
0 |
0.2000 |
0.3000 |
0 |
0 |
|
2 |
0.1740 |
0.2740 |
0.0260 |
0.0260 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
|
|
5 |
0.0727 |
0.1727 |
0.1273 |
0.1273 |
|
6 |
0.0350 |
0.1350 |
0.1650 |
|
|
②在3min-4min之间,反应处于 状态。(填“平衡”或“非平衡”)
③第6min时,平衡向 方向移动,可能的原因是 。
24. 以下是某课题组设计的合成聚酯类高分子材料
以下是某课题组设计的合成聚酯类高分子材料 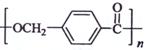 的路线:
的路线:
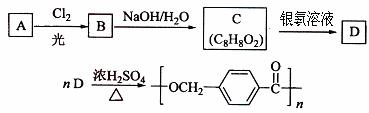

 已知:
已知: ①A的相对分子质量小于110,其中碳的质量分数约为0.9;
①A的相对分子质量小于110,其中碳的质量分数约为0.9;
 ②同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮:
②同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮:
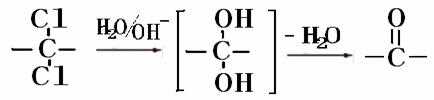
 ③C可发生银镜反应。
③C可发生银镜反应。
 请根据以上信息回答下列问题:
请根据以上信息回答下列问题:
 (1)A的分子式为
;
(1)A的分子式为
;
 (2)由A生成B的化学方程式为
,反应类型是
;
(2)由A生成B的化学方程式为
,反应类型是
;
 (3)由B生成C的化学方程式为
,该反应过程中生成的不稳定中间体的结构简式应是
;
(3)由B生成C的化学方程式为
,该反应过程中生成的不稳定中间体的结构简式应是
;
 (4)D的结构简式为
,D的同分异构体中含有苯环且水解产物之一为 乙酸的有
(写结构简式)。
(4)D的结构简式为
,D的同分异构体中含有苯环且水解产物之一为 乙酸的有
(写结构简式)。
23.化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与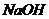 溶液反应,X的原子结构示意图为
。
溶液反应,X的原子结构示意图为
。
(2)X的硫酸盐溶液与过量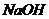 溶液反应的离子方程式为
溶液反应的离子方程式为
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与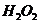 反应,其产物之一是Y的单质,Y的单质的电子式为
;
反应,其产物之一是Y的单质,Y的单质的电子式为
;
Z分子的结构呈
②A的化学式是
(4)X的单质、石墨和二氧化钛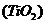 按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭河导弹上有重要应用),其反应的化学方程式是
按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭河导弹上有重要应用),其反应的化学方程式是
22.实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,反应原理为: 4NH4++6HCHO=3H++6H2O+(CH2)6N4H+
滴定时,1 mol(CH2)6N4H+与 l mol H+相当,然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
(1) 称取样品1.500g
(2) 将样品溶解后完全转移到250 mL容量瓶中,定容,充分摇匀。
(3) 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。
按上述操作方法再重复2次,回答问题:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”,下同)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积______
③滴定时边滴边摇动锥形瓶,眼睛应观察 _____
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时锥形瓶的现象为
⑤滴定结果如下表所示:
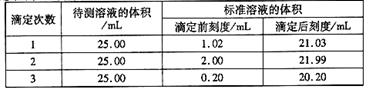
若NaOH标准溶液的浓度为0.1010mol·L-1,该样品中氮的质量分数为_______
21.根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
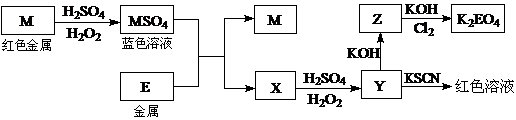
⑴写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
⑵某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 、 。
⑶写出Cl2将Z氧化为K2EO4的化学方程式: 。
 ⑷由E制备的E(C5H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为:
⑷由E制备的E(C5H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: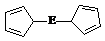 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
20. 用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu2 (OH)2CO3后恰好恢复到电解前的浓度和pH值(不考虑二氧化碳的溶解)。则电解过程中共转移的电子数为
A.0.4mol B.0.5mol C.0.6mol D.0.8mol
19.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是
A.密闭容器中CuO和C高温反应的气体产物: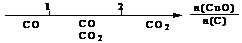

B.Fe在Cl2中的燃烧产物: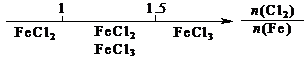

C.AlCl3溶液中滴加NaOH后铝的存在形式:

D.氨水与SO2反应后溶液中的铵盐: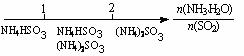
18.根据以下事实得出的判断一定正确的是

A.HA的酸性比HB的强,则HA溶液的pH比HB溶液的小

B.A+和B-的电子层结构相同,则A原子的核电荷数比B原子的大

C.A盐的溶解度在同温下比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大

D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com